|
|
| |
MOLECOLE POLIATOMICHE
Il metodo dell'orbitale molecolare utilizzato per le molecole biatomiche rappresenta il punto logico di partenza per la comprensione anche dei sistemi poliatomici.
Vi sono due metodi per rappresentare gli orbitali molecolari nelle molecole poliatomiche:
Quando gli elettroni nelle molecole poliatomiche non sono localizzati fra due atomi soltanto della molecola poliatomica ma bensì sono delocalizzati su diversi atomi, si utilizza la teoria del 131j93b l'orbitale molecolare delocalizzato, ma questo metodo è concettualmente diverso dalla rappresentazione di Lewis dove il legame chimico sta solo fra due atomi.
Un altro metodo di rappresentare queste molecole complesse è di usare orbitali localizzati fra due atomi, con la teoria dell'orbitale molecolare localizzato.
La teoria dell'orbitale molecolare delocalizzato è utile per legami asimmetrici π come il benzene, dove la struttura di Lewis possiede due o più strutture risonanti.
Orbitali molecolari localizzati per BeH2, BH3 e CH4:
BeH2:
Nella molecola BeH2, per formare orbitali di legame localizzati, bisogna considerare gli orbitali di valenza che nel berillio sono due, questi vanno verso i due idrogeni Ha e Hb.
Questo si ottiene pero ibridizzando cioè mescolando gli orbitali 2s e 2p ottenendo così due orbitali ibridi perfettamente uguali spa e spb che vanno rispettivamente verso Ha e Hb.
L'orbitale spa si sovrappone all'orbitale 1sa dell'Ha e l'orbitale spb si sovrappone all'orbitale 1sb dell'Hb.
Entrambi gli orbitali ibridi localizzati sp hanno per metà carattere di s e per metà carattere di p e sono sufficienti a legare con i due idrogeni per dar luogo alla molecola.
BH3:
Nella molecola BH3 il boro ha tre orbitali di valenza, e il legame secondo la teoria dell'orbitale molecolare localizzato si ottiene ibridizzando l'orbitale 2s con l'orbitale 2p, ottenendo così tre orbitali ibridi equivalenti sp2, ciascuno di questi orbitali ibridi avrà per 1/3 carattere di s e per 2/3 di p, questi tre orbitali ibridi si sovrappongono rispettivamente a ciascun orbitale 1s dei tre idrogeni, dando luogo ad una molecola planare trigonale.
CH4:
Nella molecola CH4 invece il carbonio ha ben quattro orbitali di valenza per cui ibridizzando gli orbitali 2s e 2p si ottengono quattro orbitali ibridi equivalenti sp3, dove tutti e quattro hanno per ¼ carattere s e per ¾ carattere p e si legano ai quattro idrogeni.
Questa molecola ha forma tetraedrica, e i tre orbitali ibridi sp3 si dicono ibridi tetraedrici.
L'idrogeno nei legami a ponte:
Nelle molecole viste in precedenza CH4 ha una configurazione a guscio chiuso, a differenza di BeH2 e BH3 che usano i loro orbitali vuoti per formare aggregati molecolari più grandi.
Ad esempio l'idruro di berillio (BeH2) è un solido i cui atomi di idrogeno condividono elettroni con gli atomi di berillio della molecola successiva mediante legami a ponte.
H H H H H H
\ / \ / \ / \ / \ / \
Be Be Be Be Be (Legami a Ponte)
/ \ / \ / \ / \ / \ /
H H H H H H
In un certo senso ciascun berillio nel solido condivide otto elettroni raggiungendo un guscio chiuso.
Il composto invece BH3 ha formula molecolare B2H6 ed è detto diborano, dove due unità di BH2 sono legate da due legami a ponte.
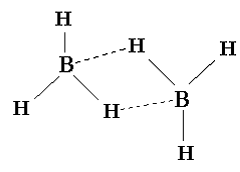
Teorie dell'orbitale molecolare localizzato per molecole con coppie solitarie di elettroni:
La molecola di ammoniaca NH3 ha quattro coppie di elettroni di valenza come CH4, però non tutte le coppie sono equivalenti perché l'ammoniaca non ha quattro legami ma ne ha tre più una coppia solitaria:
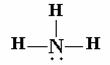 (Struttura di Lewis)
(Struttura di Lewis)
La coppia solitaria si trova nell'orbitale 2s dell'azoto, questa molecola in accordo con il metodo VSEPR ha una forma tetraedrica (piramide trigonale).
Per la sistemazione di una molecola di questo tipo si utilizzano quattro orbitali ibridi sp3, dove tre andranno a formare il legame con gli orbitali 1s dell'idrogeno, e il restante orbitale ibrido ospiterà la coppia di elettroni solitaria.
Legami singoli e legami multipli in composti del carbonio:
Per i composti del carboni gli orbitali ibridi sp3 tetraedrici spiegano molto bene la loro struttura, e questi composti idrocarburi sono detti saturi perché ciascun atomo di carbonio usa tutti e quattro i suoi orbitali di valenza per legare quattro atomi con un legame
Mentre i composti sono insaturi se invece il carbonio utilizza solo due o tre orbitali di valenza per formare un legame
Un esempio di molecola insatura è C2H4 :
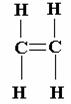
questa molecola utilizza tre orbitali ibridi sp2 , due di questi legano con i due idrogeni, e l'ultimo lega un legame singolo con l'altro carbonio, mentre il secondo legame con il carbonio è formato dai due orbitali atomici 2p, non ibridizzati che danno luogo ad un orbitale π.
In conclusione nella molecola C2H4 il doppio legame del carbonio consiste in un legame ed un legame π, mentre in C2H2 il triplo legame è costituito da un legame e da due legami π.
Benzene ed orbitali delocalizzati:
Con il Benzene (C6H6) Il metodo dell'orbitale molecolare localizzato fallisce, e quindi bisogna utilizzare il metodo dell'orbitale delocalizzato.
![]()
![]()
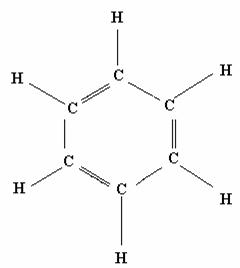
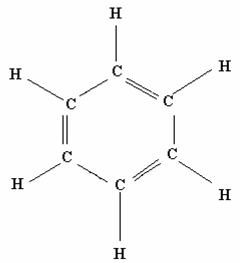
(Struttura di Lewis)
In una struttura come il benzene che possiede delle strutture di risonanza, ciascun atomo di carbonio possiede un ibridazione sp2 dove ogni atomo di carbonio forma un legame con un atomo di idrogeno e due di carbonio, avanzano perciò altri sei elettroni di valenza con altri sei orbitali p.
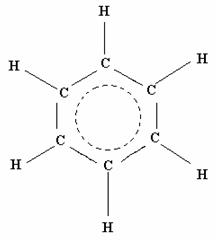
I sei elettroni di valenza non utilizzati occuperanno i tre orbitali di legame formati dai sei orbitali atomici p e gli elettroni saranno quindi delocalizzati, in modo che nessuna coppia di elettroni appartiene a coppie di atomi di carbonio ma ciascun legame di carbonio consiste in un legame completo e da mezzo legame π, dove i tre legami π sono delocalizzati su tutti e sei gli atomi di carbonio.
Per cui la molecola si rappresenta meglio in questo modo:
Molecole poliatomiche polari e non polari:
Le molecole biatomiche etronucleari sono polari mentre quelle omonucleari non lo sono.
Una molecola non polare ha un momento dipolare uguale a zero.
![]() Nelle molecole poliatomiche vi sono numerosi esempi
di molecole che hanno legami che sono polari ma la molecola globale non lo è,
ad esempio una molecola di questo tipo è CCl4 che possiede un
piccolo dipolo nel legame C Cl
perché il cloro è più elettronegativo del carbonio eppure la geometria
molecolare da luogo ad un momento dipolare uguale a zero e la molecola non è
polare.
Nelle molecole poliatomiche vi sono numerosi esempi
di molecole che hanno legami che sono polari ma la molecola globale non lo è,
ad esempio una molecola di questo tipo è CCl4 che possiede un
piccolo dipolo nel legame C Cl
perché il cloro è più elettronegativo del carbonio eppure la geometria
molecolare da luogo ad un momento dipolare uguale a zero e la molecola non è
polare.
Mentre la molecola CH3Cl è polare perché C e H hanno circa la stessa elettronegatività per cui non hanno nessun contributo polare mentre il legame carbonio cloro rende la molecola polare perché cloro e carbonio hanno una differenza di elettronegatività abbastanza elevata e le coppie solitarie presenti sul cloro spiegano il momento dipolare della molecola.
Anche l'acqua è una molecola polare, infatti, l'ossigeno è più elettronegativo dell'idrogeno e in più l'ossigeno ha due coppie solitarie di elettroni.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025