|
|
| |
IL LEGAME CHIMICO
Il legame chimico è un'interazione tra forze di natura precipuamente elettrica che si manifesta tra atomi uguali o diversi con conseguente formazione di molecole o aggregati atomici più o meno stabili. Legami analoghi sono quelli che intervengono tra più molecole o cristalli per costituire i raggruppamenti di maggiori dimensioni formanti le varie sostanze. Dal tipo di legame prevalente dipendono le proprietà fisico-chimiche delle sostanze, come p. es. la densità, la durezza, il comportamento metallico, non metallico o anfotero, il punto di fusione 848h73i , la conducibilità elettrica, ecc. Le forze responsabili dei legami sono una diretta conseguenza della natura dell'atomo e della sua struttura elettronica. Un atomo può perdere o acquistare elettroni (carichi negativamente) diventando così uno ione positivo (catione) o negativo (anione). Per strappare un elettrone a un atomo si richiede però una quantità di energia definita dal cosiddetto potenziale di ionizzazione; quando invece un atomo cattura un elettrone si ha l'emissione di una certa quantità di energia, definita come affinità elettronica. Gli atomi più stabili sono quelli che presentano altissimi potenziali di ionizzazione e affinità elettronica praticamente trascurabile. Tra atomi a basso potenziale di ionizzazione e atomi ad alta affinità elettronica si stabilisce un legame detto ionico o eteropolare; tra atomi a elettronegatività non molto diversa o identica si stabiliscono legame detti covalenti; tra atomi elettropositivi si instaura un legame detto metallico.
Si verifica tra atomi o gruppi di atomi spiccatamente distinti in elettropositivi o elettronegativi, così da consentire l'effettivo passaggio di uno o più elettroni dall'elettropositivo all'elettronegativo; ciò comporta la formazione di ioni di segno opposto tra i quali si stabilisce una forza di attrazione elettrostatica che appunto costituisce il legame ionico. Col passaggio di elettroni da un atomo all'altro si tende a raggiungere per entrambi una configurazione elettronica più stabile, che risulta ottimale quando il livello esterno di ognuno contiene un numero di elettroni pari a quello del gas inerte più vicino nel sistema degli elementi. Così, nella formazione del cloruro di sodio, l'atomo di sodio cede con facilità l'unico elettrone del livello più esterno trasformandosi in ione Na con configurazione elettronica identica a quella del neo, mentre l'atomo di cloro con sette elettroni nel livello più esterno, assumendo l'elettrone ceduto dal sodio si trasforma nello ione Cl con configurazione elettronica identica a quella dell'argo. Nella formazione del solfuro di calcio, CaS, il trasferimento di due elettroni dall'atomo di calcio a quello di zolfo determina la comparsa degli ioni Ca e S entrambi con configurazione elettronica identica a quella dell'argo. Va tenuto presente che i composti a netto legame ionico non sono formati da molecole discrete né allo stato solido né in quello fuso o di soluzione; solo allo stato di vapore e per quei composti che possono vaporizzare senza decomporsi si può parlare di molecole. Ciò è dovuto al fatto che negli ioni la carica è distribuita uniformemente sulla loro superficie e quindi essi esercitano un'azione elettrostatica che agisce in tutte le direzioni allo stesso modo, cosicché ogni ione positivo può risentire dell'attrazione di molti ioni negativi e ognuno di questi a sua volta subire l'attrazione di molti ioni positivi. Allo stato solido gli ioni si dispongono nei nodi di reticoli spaziali ordinati, in modo che ognuno raggruppi attorno a sé il maggior numero di ioni di segno opposto con la più alta simmetria possibile, sempre alla condizione che l'insieme risulti elettricamente neutro (struttura ionica). L'edificio cristallino così formato presenta una struttura specifica dipendente dalle caratteristiche degli ioni partecipanti, ma senza dimensioni determinate. Così p. es. per il cloruro di sodio la formula NaCl esprime solo il rapporto secondo il quale gli atomi di sodio si combinano con quelli di cloro e non ha quindi significato di molecola discreta in quanto allo stato solido gli ioni Na e Cl risultano distribuiti in un reticolo cristallino nel quale ciascun ione Na è circondato a uguale distanza da sei ioni Cl e viceversa; allo stato fuso o in soluzione gli ioni si separano e migrano indipendentemente gli uni dagli altri senza che sia possibile attribuire un singolo ione Cl a un determinato ione Na e così via. Il legame ionico è molto frequente nei composti inorganici: alogenuri, ossidi, carbonati, solfati, fosfati e silicati generalmente presentano una struttura reticolare ionica. Proprietà comuni a questi composti, dipendenti dalla natura del legame e dalla sua elevata forza, sono il comportamento da elettroliti allo stato fuso o di soluzione, così da consentire il passaggio della corrente elettrica, la presenza di punti di fusione molto alti, da 300 a oltre 1000 ºC, una debole volatilità, la solubilità nei solventi polari come l'acqua e l'insolubilità quasi totale in quelli apolari come gli idrocarburi, il tetracloruro di carbonio, ecc.
Si instaura tra atomi che hanno tendenza ad acquistare elettroni più o meno uguale. Per raggiungere una configurazione più stabile, essi mettono in compartecipazione un ugual numero di elettroni, così che ognuno disponga di un livello esterno saturo. Gli elettroni utilizzabili sono solo quelli spaiati, ossia singoli occupanti di orbitali dello strato di valenza. Se si tratta di atomi uguali la coppia o le coppie di elettroni in comune (doppietto elettronico) sono ugualmente condivise: tale legame viene detto omopolare (presente, p. es., nella molecola biatomica degli alogeni). Nel caso del fluoro, l'ultimo orbitale risulta parzialmente occupato e il suo elettrone viene messo in comune con un altro atomo di fluoro che analogamente fa col suo elettrone spaiato. In tal caso, i due elettroni comuni si muovono lungo un orbitale, detto molecolare perché comune ai due atomi della molecola, risultante dalla sovrapposizione e compenetrazione dei due orbitali atomici originali. Rappresentando solo gli elettroni di valenza del fluoro si può così esprimere la formazione della molecola F
![]() _[1v\h8"f13_54.wmf"_[0v
_[1v\h8"f13_54.wmf"_[0v
e considerando solo gli elettroni realmente partecipanti al legame
![]() _[1v\h8"f13_55.wmf"_[0v
_[1v\h8"f13_55.wmf"_[0v
Un particolare l. covalente omopolare si ha nella molecola dell'idrogeno in quanto non vi si realizza la costituzione di un ottetto ma solo il completamento del primo livello:
![]() _[1v\h8"f13_56.wmf"_[0v
_[1v\h8"f13_56.wmf"_[0v
Quando tra gli atomi esiste una differenza sensibile di elettronegatività, gli elettroni messi in comune risentono maggiormente dell'attrazione esercitata dall'atomo più elettronegativo in quanto la densità della nube elettronica non è uniforme e risulta più elevata in vicinanza dell'atomo più elettronegativo: ne consegue la presenza nella stessa molecola di zone diversamente cariche. In queste condizioni il legame è detto covalente polarizzato o semplicemente covalente. Le molecole covalenti nelle quali il baricentro delle cariche positive non coincide con quello delle negative si comportano da dipoli: un significativo esempio è offerto dalla molecola dell'acqua. La formazione di legami covalenti è dovuta all'interazione di orbitali, ossia alla loro sovrapposizione e compenetrazione: i legami risultano tanto più stabili quanto più favorevoli sono le caratteristiche geometriche degli orbitali interessati. I legami covalenti sono assai diffusi soprattutto nei composti organici; i principali caratteri distintivi dei composti covalenti sono incapacità di condurre corrente elettrica sia allo stato fuso sia in soluzione, facile fusibilità, elevata volatilità, scarsa solubilità nei solventi polari ed elevata solubilità in quelli apolari. Esiste una terza forma di legame covalente detto legame dativo: in questo, detto anche semipolare o covalente coordinato o di coordinazione, gli elettroni necessari alla formazione della coppia condivisa sono forniti da uno solo degli atomi presenti. Si consideri il complesso F BNH che si ottiene da ammoniaca, NH , e fluoruro di boro, BF , e la distribuzione degli elettroni di valenza:
![]() _[1v\h8"f13_57.wmf"_[0v
_[1v\h8"f13_57.wmf"_[0v
Risulta che l'azoto ha messo in comune col boro una sua coppia di elettroni: l'azoto si comporta da donatore mentre il boro funge da accettore. Il legame dativo spesso si rappresenta con una freccia tra donatore e accettore
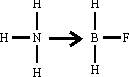 _[1v\h8"f13_58.wmf"_[0v
_[1v\h8"f13_58.wmf"_[0v
Il legame dativo è tipico di una vasta classe di composti detti complessi o composti di coordinazione caratterizzati dal fatto che in essi alcuni elementi, particolarmente quelli di transizione, mostrano una capacità di combinazione superiore a quella normale pronosticabile in base alle loro valenze. Nel caso dello ione esacianoferrato (III), [Fe(CN) , lo ione Fe riesce infatti a coordinare sei ioni CN col risultato di formare uno ione risultante dotato di tre cariche negative.
Si riscontra tra atomi con pochi elettroni nel livello più esterno, i metalli appunto: a esso si devono le caratteristiche proprietà fisiche presentate da questi. Si ammette che gli elettroni di valenza non siano vincolati ai rispettivi atomi metallici ma che possano muoversi per tutto il reticolo cristallino costituito dagli ioni positivi derivati dagli atomi metallici appunto per allontanamento degli elettroni: il metallo risulta quindi un aggregato di ioni positivi immerso in una nube elettronica. Gli ioni non presentano orientamenti preferenziali nello spazio ma tendono a consentire la più densa occupazione possibile dello spazio che raggiunge il massimo nel reticolo cubico a facce centrate, presentato p. es. da ferro, rame, piombo, oro e argento, e nel reticolo esagonale compatto presente nel magnesio, nel berillio e nel cadmio. Gli elettroni liberi, pur essendo comuni a tutto il cristallo, non risultano però uniformemente distribuiti e neppure nelle stesse condizioni energetiche: si ritiene che possano circolare solo in determinate bande formate da un gran numero di livelli energetici permessi molto vicini fra loro; ognuno di questi livelli conterrebbe due elettroni e quindi risulterebbe una specie di orbitale esteso però all'intero cristallo. La reciproca attrazione tra ioni metallici ed elettroni realizza il legame metallico che risulta molto forte, anzi il più forte considerando l'elevato punto di fusione di gran parte dei metalli.
Parametri caratteristici dei legami chimici sono la lunghezza, l'angolo e la forza di legame; essi variano anche sensibilmente secondo le molecole a cui si riferiscono per fenomeni di risonanza o di effetto induttivo legato alla presenza di gruppi elettronattrattivi o elettronrepulsivi. La lunghezza di legame è data dalla distanza tra i centri dei nuclei dei due atomi considerati nello stato fondamentale non eccitato. La forza o energia di legame esprime il lavoro necessario per ottenere la completa separazione dei due atomi legati in modo che tra loro non si manifesti più alcuna forza attrattiva; in genere si indica in chilocalorie per mole del composto considerato. La determinazione dell'angolo di legame riveste notevole importanza in stereochimica.
Le molecole polari possono interagire a causa dell'attrazione elettrostatica tra poli di carica opposta disponendosi ciascuna con il polo positivo rivolto verso quello negativo della vicina. Ciò crea un legame detto dipolare o di polarizzazione, la cui forza non è elevata e risente molto del grado di polarità, della forma molecolare e della temperatura: a parità di condizioni, infatti, il legame dipolare risulta tanto più forte quanto più bassa è la temperatura. Anche tra molecole non dotate di polarità si manifestano legami intermolecolari molto deboli, evidenti solo in assenza di forze di altra natura, dovuti alla polarizzazione della configurazione elettronica di ogni atomo per l'induzione esercitata dal campo elettrico degli atomi circostanti: ciascuna molecola si comporta allora come un dipolo soggetto all'attrazione dei dipoli vicini. A queste forze conosciute come forze di Van der Waals si deve la formazione dei cosiddetti solidi molecolari, il cui reticolo è appunto costituito da molecole che interagiscono solo attraverso le forze suddette. I gas inerti, l'idrogeno, il biossido di carbonio e lo iodio in condizioni opportune di temperatura e pressione sono esempi di solidi molecolari. La debolezza di questo legame è denunciata dal basso punto di fusione, dalla scarsa durezza, dall'alto coefficiente di dilatazione e dal basso calore di sublimazione che caratterizza i solidi molecolari.
Nelle molecole contenenti atomi
di idrogeno legati ad atomi di piccole dimensioni, di notevole
elettronegatività e con doppietti elettronici non condivisi (per lo più si
tratta di ossigeno o di azoto), si instaura un legame covalente, ma per lo
spostamento degli elettroni di legame verso l'atomo più elettronegativo
l'idrogeno risulta parzialmente positivo e l'altro atomo parzialmente negativo:
pertanto tra l'idrogeno, che tende ad assumere lo stato di ione positivo, e un
atomo parzialmente negativo di un'altra analoga molecola si manifestano delle
forze di carattere elettrostatico più deboli dei normali legami ionici o
covalenti ma sufficienti a costituire ostacolo al movimento delle molecole; la
presenza di questi legami influenza soprattutto le proprietà fisiche. Un
singolo atomo di idrogeno risulta quindi legato contemporaneamente a due atomi
distinti, all'uno con un legame covalente e all'altro con un legame molto più
debole, il legame a idrogeno appunto, che comunemente si rappresenta con dei
puntini. Di questo tipo sono i legame che si creano tra le molecole d'acqua.
Legami a idrogeno possono interessare due sole molecole costituendo dei dimeri
come nel caso dell'acido acetico 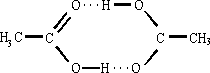 _[1v\h8"f13_59.wmf"_[0v
_[1v\h8"f13_59.wmf"_[0v
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025