|
|
| |
Ipertrofia miocardica
L'ipertrofia è definita come un aumento di massa di un tessuto derivante dall'aumento di volume delle cellule che lo compongono. A differenza dell'iperplasia, il numero di cellule totali componenti il tessuto non aumenta, anche se in entrambi i casi si assiste a una modifica della matrice extracellulare.
L'ipertrofia è la risposta più comune del miocardio a stress di differente natura e può essere indotta da molteplici fattori, riconducibili nella maggior parte dei casi a sovraccarico pressorio o a inadeguatezza del tessuto contrattile a sostenere il normale carico pressorio, come avviene nell'insufficienza cardiaca. Alla risposta ipertrofica contribuisce l'attivazione neuroumorale, sostenuta principalmente dal sistema renina-angi 252b15c otensina (RAS) e dal sistema nervoso ortosimpatico.
L'ipertrofia ventricolare è una risposta inizialmente adattativa, in quanto l'aumento del numero di sarcomeri "in parallelo" aumenta la forza sviluppabile e l'aumento di spessore riduce lo stress di parete. Tuttavia, con il perdurare della condizione di sproporzione fra contrattilità e carico meccanico imposto dal circolo, le stesse risposte adattative conducono a modificazioni della funzione cellulare di significato patologico. Si parla in questo caso di maladattamento. Il processo attraverso cui l'attivazione cronica delle risposte adattative cellulari provoca la perdita di funzione del miocardio è definito rimodellamento. Il rimodellamento è caratterizzato da una serie di modifiche cellulari e della matrice extracellulare, a cui contribuiscono meccanismi di tipo "infiammatorio", attivazione neuroumorale e ROS. La conseguenza finale del rimodellamento è la transizione dalla fase ipertrofica a una fase dilatativa, caratterizzata dalla perdita di tessuto contrattile per morte cellulare. Ne consegue assottigliamento delle pareti ventricolari, aumento il volume interno della camera e, quindi, dello stress di parete. La fase dilatativa rappresenta lo stadio terminale dell'evoluzione verso l'insufficienza cardiaca assoluta.37 (fig. 1.3)
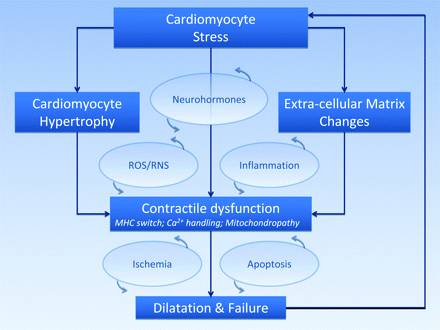
Fig. 1.3 Schema generale degli eventi che conducono a insufficienza cardiaca. A causa di differenti fattori i miociti ventricolari vengono sottoposti a condizioni di stress, che inducono ipertrofia e modifiche nella matrice extracellulare; la disfunzione contrattile conseguente conduce a dilatazione della camera cardiaca e insufficienza ventricolare, che a sua volta sottopone i miociti sopravvissuti a condizioni di ulteriore stress.
Durante il rimodellamento miocardio si producono alterazioni nell'espressione genica di numerose proteine chiave per l'attività dei cardiomiociti. Sono state descritte modifiche nell'espressione delle proteine contrattili, quali variazioni di espressione delle isoforme della catena pesante della miosina (da a ) e dell'actina (da cardiaca a scheletrica o del muscolo liscio)30;38;39. L'isoforma della catena pesante della miosina ha una minore attività ATPasica, e ciò si traduce nel vantaggio di un minior consumo di ossigeno, ma anche in una netta diminuzione della funzione sistolica39-41. Non sono chiare le conseguenze funzionali delle modifiche riguardanti l'actina, ma è possibile che altre proteine regolatorie come troponina e tropomiosina possano essere coinvolte nelle alterazioni funzionali tipiche dell'insufficienza cardiaca.40;41
La matrice extracellulare viene modificata durante il rimodellamento grazie all'aumento della produzione di fattori trascrizionali quali il TGF-1. Quest'ultimo provoca l'attivazione delle metalloproteasi e la conseguente degradazione della matrice, fenomeno che sembra condizionare il passaggio da fase ipertrofica a fase dilatativa. L'aumento delle concentrazioni tissutali di interleuchina-1, interleuchina-6 e TNF- contribuisce alla facilitazione dell'apoptosi dei miociti. La perdita cellulare viene compensata con l'aumento nel contenuto tissutale di collagene, che irrigidisce la parete ventricolare e danneggia il rilassamento diastolico. La fibrosi miocardia è particolarmente pronunciata nel rimodellamento del ventricolo destro conseguente a ipertensione polmonare, caratteristico della condizione di ipossia cronica; ciò sembra suggerire un effetto aggravante dell'ipossia sul rimodellamento della matrice intercellulare.
Sono stati sviluppati e caratterizzati differenti modelli sperimentali di ipertrofia miocardica, sia per il ventricolo sinistro che per il destro. Il modello più diffuso è un modello di ipertrofia indotta da sovraccarico pressorio. Per quanto riguarda il ventricolo sinistro il sovraccarico di pressione si ottiene mediante "aortic banding", ovvero inducendo una costrizione meccanica dell'aorta toracica o addominale. Per quanto riguarda ventricolo destro invece sono stati studiati per lo più gli effetti di condizioni che determinano l'aumento delle resistenze del microcircolo polmonare: fra di esse vi sono l'ipossia cronica (normo- o ipo-barica) e il trattamento con alcune sostanze vasoattive, come la monocrotalina. 30;42;43 (Fig. 1.4). Gli effetti della monocrotalina e, in clinica, le forme "idiopatiche" (non secondarie ad ipossia) di ipertensione polmonare hanno permesso di discriminare gli effetti della attivazione neuroumorale sistemica (presenti nel ventricolo sinistro) da quelli del sovraccarico pressorio locale (che si somma alla segnalazione sistemica
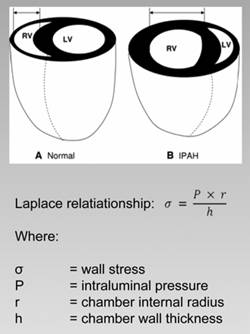
Fig. 1.4 Effetto dell'ipertrofia indotta da ipertensione polmonare arteriosa idiopatica (IPAH) sullo stress di parete. Sotto la figura è indicata la legge di Laplace, secondo la quale lo stress di parete è proporzionale alla pressione interna, al raggio interno della camera e inversamente proporzionale allo spessore della camera stessa. Come si può verificare da questa legge l'ipertrofia diminuisce lo stress di parete, cercando di compensare l'aumento di pressione interna derivante dall'aumento del postcarico.
nel ventricolo destro). Da questi studi si è concluso che il sovraccarico pressorio è il determinante principale della diminuzione di densità dei recettori -adrenergici 44, di quelli per l'angiotensina I 45 e della modifica dell'espressione delle isoforme delle proteine contrattili 38;39;46;47
A livello elettrofisiologico il rimodellamento induce un netto cambiamento dei pattern di correnti ioniche, che si riflettono generalmente in un aumento della durata del potenziale d'azione (APD). L'aumento dell'APD ha potenzialmente carattere compensatorio, in quanto favorisce l'accumulo di Ca2+ intracellulare e, quindi, la contrattilità. Tuttavia, un aumento eccessivo di APD può avere conseguenze potenzialmente letali, in quanto una eccessiva durata della fase 2 del potenziale d'azione facilita la comparsa di post-potenziali precoci (EADs). Le EADs derivano dal recupero dall'inattivazione dei canali di Na+ e Ca2+ durante la fase di plateau del potenziale d'azione e favoriscono l'insorgenza di aritmie, con possibile fibrillazione ventricolare e arresto cardiaco.
In molti modelli di ipertrofia del ventricolo sinistro si osserva una diminuzione nella densità di ICaL e Ito, due correnti fondamentali rispettivamente per la fase di plateau del potenziale d'azione e per la ripolarizzazione 48. E' interessante come tali alterazioni siano osservate in precedenti studi anche nell'ipertrofia del ventricolo destro indotta da ipossia ipobarica cronica 42
In un modello murino di ipertrofia è stata riscontrata una maggiore attivazione della calcio-calmodulina chinasi, o CaMKII 49. Tale incremento di attività deriva dall'attivazione costitutiva del sistema -adrenergico, ma anche dal generale aumento di calcio citosolico caratteristico dell'insufficienza contrattile. L'azione della CaMKII si esplica mediante fosforilazione di numerosi componenti chiave dell'accoppiamento eccitazione contrazione e la sua attivazione cronica può essere una delle cause del rimodellamento. La CaMKII stimola SERCA, mediante fosforilazione della proteina regolatoria fosfolambano. Inoltre essa aumenta la probabilità diapertura dei RyR e dei canali di calcio di tipo L. E' stata inoltre proposta l'ipotesi di una fosforilazione mediata dalla CaMKII a livello del canale del sodio e di diversi canali del potassio, tra cui Kv4.3 (la principale isoforma correlata alla Ito). La fosforilazione del canale del Na+ altera le sue proprietà biofisiche, con uno spostamento della curva di inattivazione verso potenziali più negativi, una minore cinetica di recupero dall'inattivazione e un aumento significativo della corrente persistente INaL.48;50
Tale corrente è di rilevante importanza dal punto di vista delle modifiche elettrofisiologiche indotte da ipertrofia, rimodellamento e ipossia, in quanto è noto che condizioni di ipossia acuta e subacuta aumentano la densità di INaL e che questa corrente è aumentata in condizioni di ipertrofia maladattativa conseguente a numerose patologie.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025