|
|
| |

Classe: .
Sezione: .
Data di consegna: ...
Calore: forma d'energia che si trasferisce tra due corpi messi a contatto, o tra due parti di uno stesso corpo, che si trovano in condizioni termiche diverse. Il calore è energia in transito: fluisce sempre dai punti a temperatura maggiore a quelli a temperatura minore, finché non viene raggiunto l'equilibrio termico, dove i sistemi si trovano alla stessa temperatura. Viene indicato con la lettera Q, e la sua unità di misura è il Jaul (unità di misura dell'energia). Q = J Q = m * Cs. DT (Tf - Ti)
Temperatura: il concetto di temperatura è associato all'idea di fornire una misura relativa di quanto i corpi risultino freddi o caldi al tatto, essa è la proprietà di un corpo ed è una grandezza fisica che esprime lo stato termico del corpo stesso. Viene indicata con la lettera T e la sua unità di misura è il °C e nel sistema internazionale il Kelvin (K).
T = °C o K
Termometro: strumento utilizzato per effettuare misurazioni di temperatura. Il tipo più comunemente usato è quello a mercurio, costituito da un tubo capillare di vetro, a diametro costante, che reca a una estremità un bulbo riempito del metallo liquido, il tutto sigillato per assicurare un vuoto parziale nel capillare. Se la temperatura aumenta, il mercurio si dilata e sale nel capillare: il livello raggiunto fornisce una misura indiretta di temperatura, che viene letta su una scala graduata propriamente tarata. Al posto del mercurio si possono usare alcol, etere o altri liquidi.
Esiste un'ampia varietà di dispositivi usati come termometri, tutti basati su un metodo di misurazione indiretta:
termometro a liquido
termometro a resistenza elettrica
termometro a gas
termometro a termocoppia
Equilibrio termico: due corpi posti in contatto termico sono in equilibrio quando hanno entrambi la stessa temperatura. L'esperienza mostra che, ponendo a contatto un corpo freddo e uno più caldo, si verifica uno scambio di calore, al termine del quale le temperature dei due corpi raggiungono un valore comune, intermedio tra la temperatura del corpo freddo e quella del corpo caldo; il valore della temperatura di equilibrio dipende naturalmente dalle temperature iniziali dei due cor 323j93d pi, ma anche dalle sostanze di cui sono costituiti e dalla loro massa. Ad esempio, se lasciassimo cadere una moneta calda in un bicchiere di acqua fredda, la moneta cederebbe parte del calore all'acqua, e dopo un determinato intervallo di tempo, il sistema raggiungerebbe uno stato di equilibrio, in cui l'acqua e la moneta avrebbero la medesima temperatura.
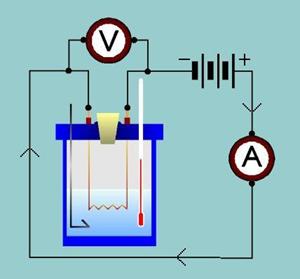
Calorimetro: strumento per la misura della quantità di calore, e per l'isolamento di un corpo, cioè non fare avvenire scambi di calore con l'esterno, che possano alterare la misura, il calorimetro più semplice e diffuso (calorimetro di Regnault) è costituito da un recipiente termicamente isolato dall'esterno (da cui il nome di adiabatico), contenente una quantità nota di acqua e corredato di un agitatore (per mantenere uniforme la temperatura dell'acqua). Esternamente è fatto come un cilindro di plastica smontabile, all'interno vi è un recipiente a forma di U fatto di pirex e rivestito con platina di argento, internamente a questo recipiente vi è dell'aria, che serve per l'isolamento delle sostanze.
Massa equivalente del calorimetro: massa di acqua che
assorbe lo stesso calore del calorimetro. ![]()
Energia: grandezza fisica che esprime la capacità di un sistema fisico a compiere lavoro. Nell'ambito meccanico, si distinguono due forme diverse di energia: l'energia cinetica, posseduta da tutti i corpi in movimento e l'energia potenziale, che un corpo possiede, ad esempio, il campo gravitazionale. Da un punto di vista più generale, l'energia esiste in molte forme diverse, che si trasformano in parte o totalmente una nell'altra: si può dunque parlare di energia termica, energia chimica, energia elettrica, energia nucleare, energia eolica, energia idraulica, energia solare e così via.
E = I * DV * t=A*V*s E = Q(carica totale) * DV
Energia elettrica: processo di trasformazione in energia elettrica di altre forme di energia, che può essere costituita dall'energia potenziale delle acque, dall'energia cinetica del vento o dall'energia luminosa e termica della luce solare. L'energia elettrica è data dalla carica che si mette in movimento, cioè dal numero di elettroni che partono per il numero delle cariche che porta ciascun elettrone.
Principio di conservazione dell'energia: principio fondamentale della fisica, secondo il quale l'energia non può essere creata né distrutta, ma può solo trasferirsi da una all'altra delle diverse forme in cui si manifesta. L'energia infatti si presenta sotto molti diversi aspetti: ad esempio, energia meccanica (cinetica e potenziale), calore, energia chimica, energia nucleare, energia luminosa e acustica, che possono venire trasformati uno nell'altro.
I dispositivi che convertono l'energia, come i motori, le lampadine e i generatori elettrici, spesso non risultano totalmente efficienti: ciò significa che non si riesce a convertire tutta l'energia in entrata nella forma finale richiesta, perché parte viene dispersa nel processo di trasformazione. Il motore di un'automobile, ad esempio, è progettato per trasformare l'energia chimica prodotta dal processo di combustione della benzina in energia meccanica della vettura, tuttavia solo il 25% circa dell'energia chimica immagazzinata nel carburante viene effettivamente sfruttato. Il resto dell'energia viene "perso" per lo scopo a cui sarebbe destinato: ciò non significa che viene distrutto, ma che assume una forma ancora diversa di energia, una delle tante e quella termica che si disperde nel suolo o nell'aria a cui l'automobile viene a contatto.

conoscere e saper utilizzare un calorimetro
misurare una temperatura
utilizzare la resistenza elettrica
capire che cos'è la massa equivalente e calcolarla
realizzare un grafico X Y
eseguire i calcoli con il numero corretto di cifre significative
montaggio di un circuito
misurazione della corrente elettrica.
misurazione della differenza di potenziale
applicare la teoria degli errori
dimostrare l'effetto Joule
Sensibilità e portata strumenti:
Sensibilità
amperometro ( I ) =
Sensibilità voltmetro ( DV ) = 0,1 V Portata voltmetro ( DV ) = 10 V
Sensibilità cronometro ( t )
= 0,5 s Portata cronometro ( t) =
Sensibilità termometro ( T )
=
termometro digitale a sonda (termocoppia)
calorimetro (con resistenza interna e agitatore)
resistenza elettrica a serpentina
supporto per resistenza elettrica
2 beker
bilancia elettronica
Tabella
|
|
M (g) |
T (°C) |
Tf (°C) |
|
|
|
|
|
|
|
|
|
|
Si prendono due beker e si riempiono d'acqua distillata, si pesa l'acqua contenuta nei corrispettivi beker, con la bilancia elettronica, e si riporta nella tabella.
Si monta la resistenza a serpentina nel supporto, si prende uno dei due beker, con l'acqua distillata e si fa riscaldare, per circa mezz'ora. Nel frattempo si prende l'altro beker e si versa l'acqua distillata in un calorimetro.
Si misura la temperatura dell'acqua versata nel termos e si riporta in tabella, dopodiché si prende l'acqua messa a riscaldare, si misura la temperatura e si inserisce all'interno del termos, infine si agita per avere una temperatura uniforme e si misura la temperatura di equilibrio, riportandola in tabella.
Materiale occorrente
generatore con potenziometro
voltmetro
amperometro
cavi conduttori
cronometro
calorimetro (con resistenza interna e agitatore)
termometro digitale a sonda (termocoppia)
|
N |
t (s) |
T (°C) |
DT (°C) |
E (J) |
E (Kcal) |
Q (Kcal) |
E. rel |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 Dati
Dati
DV = 8 V
I =
Cs
H2O =
mE (calorimetro) = 65,7 gr
m H2O = 500 gr
Si prende il calorimetro utilizzato per l'esperimento e si pesa sulla bilancia elettronica dopodiché, si prende un cavo e si collega un'estremità al polo positivo del generatore, l'altra estremità si collega al polo positivo dell'amperometro, si prende un secondo cavo e si collega un'estremità al polo negativo dell'amperometro, mentre l'altra estremità viene collegata all'attacco della resistenza posta sul calorimetro, si prende un terzo cavo, una estremità viene collegata al secondo attacco della resistenza sul calorimetro, mentre l'altra estremità al polo negativo del generatore. Si prendono altri due cavi e si collega l'estremità d'ognuno ai poli del voltmetro, dopodiché l'estremità del cavo collegato al polo positivo del voltmetro si collega in serie al polo del calorimetro dove vi è anche collegato il cavo che porta all'amperometro, infine si prende l'ultimo cavo e un'estremità si collega al voltmetro, e l'altra all'altro polo della resistenza posta sul calorimetro, come ultima cosa si inserisce la sonda del termometro digitale nel calorimetro.
Appena si finisce di montare il circuito si fa partire il cronometro e nello stesso tempo si accende il generatore, e ogni 60 s si prende nota della temperatura.
Formule
![]()
![]()
![]()
![]()
![]()
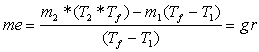
![]()
![]()
Calcolo massa equivalente
![]()
![]()
![]()
Calcolo DT
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Calcolo dell'energia (Joule)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Calcolo dell'energia (Kcal)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Calcolo della carica (Kcal)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Calcolo dell'errore relativo
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Risultati
Calcolo massa equivalente
![]()
![]()
![]()
Risultati DT
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
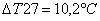
![]()
![]()
![]()
Risultati dell'energia (Joule)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
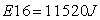
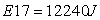
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Risultati dell'energia (Kcal)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
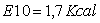
![]()
![]()
![]()
![]()
![]()
![]()
![]()
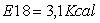
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Risultati della carica (Kcal)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Risultati dell'errore relativo
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Commenti
Come prima cosa la massa che era stata calcolata in gr è stata poi portata in Kg perché nel sistema internazionale l'unità di misura della massa è appunto il Kg.
Durante l'esperimento sono stati commessi degli errori sistematici, individuabili nei risultati degli errori relativi che sono negativi. Questi errori probabilmente sono dovuti a diversi fattori come: l'errata massa equivalente del calorimetro, forse gli attacchi della resistenza sul calorimetro facevano falso contatto, facendo così diminuire la temperatura e non ultima può essere una cattiva taratura degli strumenti utilizzati.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025