|
|
| |
INFARTO INTESTINALE
INTRODUZIONE
L'infarto intestinale rappresenta la drammatica ed irreversibile conseguenza dell'ischemia mesenterica acuta evoluta verso la necrosi della parete intestinale.
Nonostante i progressi dei presidi medico-chirurgici, il tasso di mortalità che caratterizza tale affezione risulta ancora elevato e ciò è dovuto, in particolare, al ritardo con cui spesso si giunge alla diagnosi.
Il successo è invece legato alla precoce individuazione della fase di ischemia acuta, quando non si è ancora instaurata una condizione di danno irreversibile ed è possibile effettuare interventi meno demolitivi.
Purtroppo la diagnosi precoce non risulta affatto agevole, a causa della povertà e soprattutto dell'aspecificità del quadro clinico e dei dati laboratoristici.
La presenza di «addome acuto senza addome acuto», eventuali precedenti anamnestici di angina abdominis, cardiopatie o vasculopatie di altri distretti possono soltanto indurre sospetti.
In questo stadio, neppure le immagini radiologiche standard sono discriminanti.
L'ecocolordoppler non da, in genere, risultati sicuri e non è spesso attuabile in condizioni di urgenza.
L'angiografia, pur rappresentando un valido strumento diagnostico, si dimostra non poco invasiva e non scevra da rischi anche letali. L'effettuazione indiscriminata di tale esame ha condotto in passato a trovarsi di fronte al 50% di casi negativi ed ancora oggi, in realtà, si tende all'abuso.
Un'innovazione diagnostica in tale campo è rappresentata dall'esame TC, il quale non solo è dotato di notevole sensibilità e specificità, ma risulta non invasivo ed è di facile attuazione in condizioni d'urgenza, apprestandosi a divenire l'esame di prima scelta nella diagnosi di ischemia mesenterica acuta-infarto intestinale.
Capitolo 1
CENNI DI ANATOMIA DEL CIRCOLO SPLANCNICO
La vascolarizzazione arteriosa splancnica è sostenuta da tre grossi vasi (il tronco celiaco, l'arteria mesenterica superiore, l'arteria mesenterica inferiore) e dai loro rami. Queste strutture, inoltre, sono fra loro connesse da una complessa rete di circoli collaterali.
1.1 TRONCO CELIACO
E' una grossa arteria, lunga circa 1,5 cm, che origina dalla superficie anteriore dell'aorta addominale, sotto l'orifizio aortico diaframmatico e delle arterie freniche inferiori. Decorre in avanti e verso destra, dividendosi in tre rami:
- arteria gastrica sinistra;
- arteria epatica comune;
- arteria lienale.
L'arteria gastrica sinistra risale in alto e a sinistra, e dopo aver fornito due o tre arterie esofagee, discende sulla piccola curvatura dello stomaco, anastomizzandosi con l'arteria gastrica destra.
L'arteria epatica comune, dopo l'origine a destra del tronco celiaco, fornisce l'arteria gastroduodenale e la gastrica destra, ed ascende al fegato come «epatica propria». L'arteria gastroduodenale discende tra il duodeno e la testa del pancreas dividendosi terminalmente nelle arterie gastroepiploica destra e pancreaticoduodenale superiore. Questi due rami contraggono anastomosi rispettivamente con l'arteria gastroepiploica sinistra, collaterale della lienale, e con la pancreaticoduodenale inferiore, originata dalla mesenterica superiore.
L'arteria lienale, dopo aver rilasciato rami pancreatici e gastrici brevi, fornisce l'arteria gastroepiploica sinistra, per poi terminare con i rami lienali.
1.2 ARTERIA MESENTERICA SUPERIORE
Origina dall'aorta, 1-2 cm sotto il tronco celiaco, decorre posteriormente alla testa del pancreas ed incrocia la porzione orizzontale del duodeno, per poi penetrare nella radice del mesentere. Descrivendo una curva convessa a sinistra, raggiunge la fossa iliaca destra, dove termina con l'arteria ileocolica, suo ramo terminale.
I suoi rami collaterali sono: l'arteria pancreaticoduodenale inferiore, l'arteria colica media, l'arteria colica destra, le arterie digiunali e ileali.
Figura 1.1

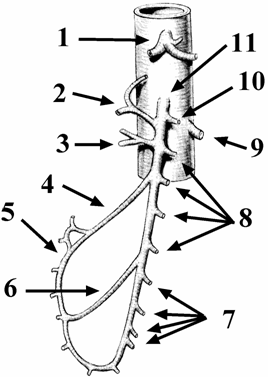
Arteria mesenterica superiore e branche collaterali.
Tratto con modifiche da: Encyclopédie Médico-Chirurgicale (Paris) 43-105 - 40-492.
L'arteria pancreaticoduodenale inferiore si divide, appena dopo l'origine, in un ramo anteriore ed uno posteriore, che si anastomizzano con altrettanti rami dell'arteria pancreaticoduodenale superiore, distribuendosi al pancreas ed al duodeno.
L'arteria colica media si dirige in avanti e verso destra, dividendosi in un ramo destro ed uno sinistro, che si anastomizzano con i corrispondenti delle arterie coliche destra e sinistra. Si vengono così a creare ampie arcate dalla cui convessità nascono piccoli rami, i quali, dividendosi ulteriormente, possono formare altre arcate.
Vascolarizza prevalentemente il colon trasverso.
L'arteria colica de 121h72b stra si divide in due rami, discendente ed ascendente, che si anastomizzano rispettivamente all'arteria ileocolica e alla colica media. Anche in questo caso si formano arcate con la stessa modalità descritta sopra.
Il territorio di distribuzione comprende il colon ascendente e la flessura destra.
L'arteria ileocolica termina dividendosi in un ramo superiore che si anastomizza con l'arteria colica destra e in uno inferiore, connesso con la terminazione dell'arteria mesenterica superiore.
Irrora l'ileo distale, il cieco e parte dell'ascendente.
Le arterie digiunali e ileali o «arterie intestinali» nascono dal lato sinistro convesso dell'arteria mesenterica superiore e si distribuiscono al digiuno e all'ileo formando una complessa rete di arcate. Dall'ultima serie di arcate, originano numerose piccole arterie rette, che raggiungono le anse fornendole così di rami terminali.
1.3 ARTERIA MESENTERICA INFERIORE
Più piccola della mesenterica superiore, nasce 6-7 cm sotto di essa e discende in basso a sinistra nella piccola pelvi terminando con l'arteria rettale superiore.
I suoi rami collaterali sono l'arteria colica sinistra e le arterie sigmoidee.
Figura 1.2
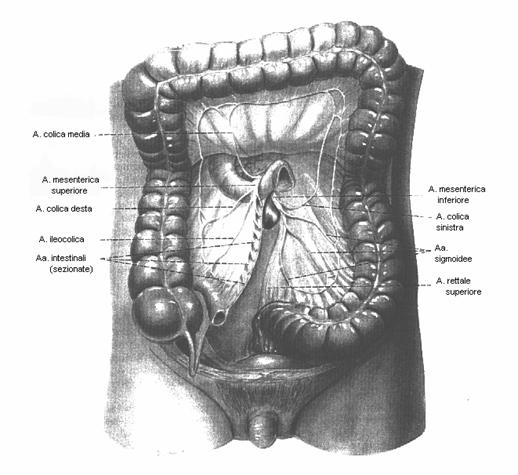
La figura mostra le arterie mesenteriche ed i loro
rami.
L'arteria colica sinistra si risolve, in genere, in un ramo ascendente che contrae anastomosi con l'arteria colica media, e in un ramo discendente che si anastomizza con la prima arteria sigmoidea.
Vascolarizza parte del colon trasverso, la flessura sinistra, il colon discendente prossimale.
Le arterie sigmoidee, in numero di 2 o 3, decorrono in basso e a sinistra, formando arcate che si distribuiscono al colon discendente distale e al sigma, anastomizzandosi con l'arteria rettale superiore.
L'arteria rettale superiore o «emorroidaria superiore» si divide in due rami che, discesi sui due lati del retto, si risolvono in rami più fini che si uniscono
all'arteria rettale media, collaterale dell'iliaca interna e alla rettale inferiore, ramo della pudenda interna.
1.4 ARCATE E CIRCOLI COLLATERALI
Le arcate e i circoli collaterali tra le arterie splancniche rivestono un ruolo clinico rilevante. Permettono infatti il mantenimento della perfusione viscerale in caso di ostruzione delle vie di circolo principali o di legatura chirurgica. E' tuttavia importante la velocità con cui si sviluppano le lesioni: se lenta, i circoli collaterali hanno il tempo di svilupparsi; se invece l'interruzione avviene in modo brutale (ad esempio per un embolo) si instaura l'ischemia acuta.
L'arcata di Barkow origina dall'anastomosi fra le arterie epiploiche destra e sinistra, derivanti dalle rispettive arterie gastroepiploiche.
L'arcata di Rio Branco deriva dall'unione dei rami anteriori e posteriori delle arterie pancreaticoduodenali e stabilisce una importante via di comunicazione tra arteria epatica e mesenterica superiore.
L'arcata di Drummond costituisce una via di comunicazione tra le due arterie mesenteriche, essendo costituita da rami della ileocolica e delle arterie coliche
destra, media e sinistra. Decorre lungo l'inserzione mesenteriale del colon sinistro e da essa originano i vasi retti.
L'arcata di Riolano, come la precedente, connette le due arterie mesenteriche, ponendo in anastomosi l'arteria colica destra con la sinistra. Sono stati descritti da Courbier quattro principali tipi di arcata di Riolano (figura 1.3), in base all'emodinamica del flusso e al calibro dell'arcata e dell'arteria emorroidaria superiore.
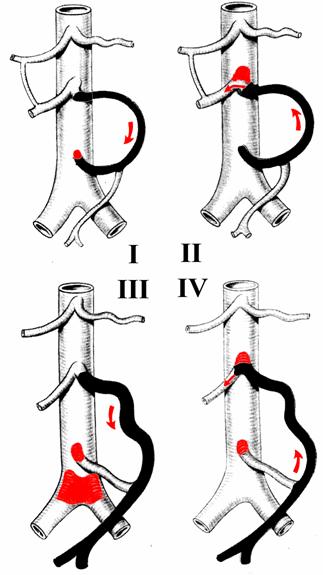
Figura 1.3
I quattro tipi di arcata di Riolano
arcata arteria emorroidaria diagnosi
di Riolano superiore
tipo 1 - piccola piccola ostruzione isolata dell'AMI
tipo 2 - grossa piccola ostruzione AMS
tipo 3 - grossa grossa ostruzione all'origine dell'AMI e del carrefour
tipo 4 - grossa grossa ostruzione osti AMS e AMI
Figura 1.4
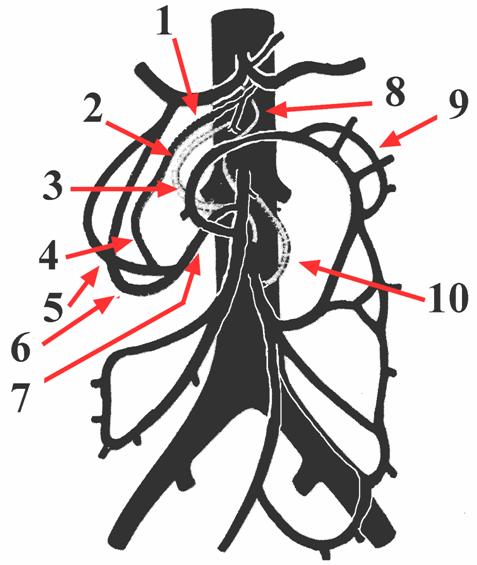
Arcate e circoli collaterali
1 - arteria pancreatica dorsale;
2 - arcata di Kirk
3 - arcata di Riolano;
4 - arcata pancreaticoduodenale posteriore;
5 - arcata pancreatico duodenale superiore;
6 - arcata di Rio Branco;
7 - arcata di Buhler;
8 - arcata di Drumond;
9 - tronco duodenopancreatico inferiore;
10 - arcata di Villemin.
Tratto con modifiche da: Encyclopédie Médico-Chirurgicale (Paris) 43-105 - 40-492.
L'arco di Buhler costituisce una anastomosi diretta tra il tronco celiaco e l'arteria mesenterica superiore. La sua presenza rappresenta un'evenienza rara (2%) ed è legata ad una mancata involuzione embriologica.
Figura 1.5
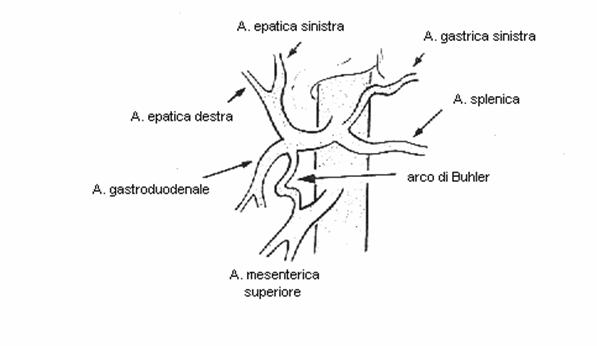
Arco di Buhler
1.5 PUNTI CRITICI DI VASCOLARIZZAZIONE
Nell'ambito di un così complesso sistema di arcate, non possono mancare punti di debolezza, i quali possono impedire il normale «salvataggio» delle anse da parte dei circoli collaterali. I più noti sono:
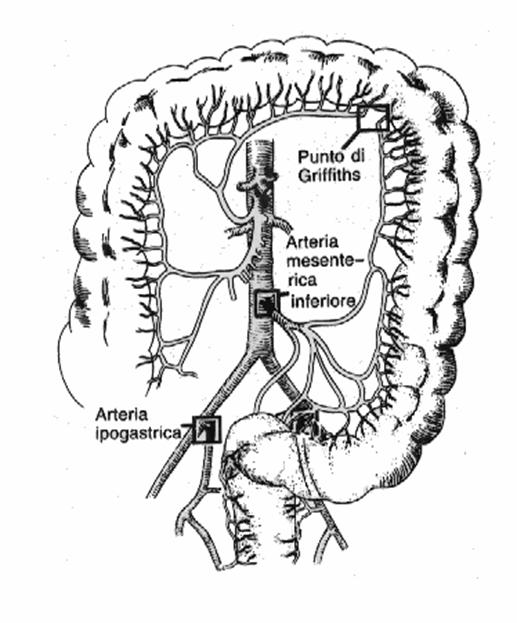
- punto di Griffith;
- punto di Sudeck;
- punto di Reiner.
Il punto di Griffith è situato a livello dell'angolo colico sinistro, tra l'arteria
colica sinistra e l'arcata del colon trasverso e interrompe il circolo di Riolano .
Il punto di Sudeck si colloca tra il sistema terminale dell'arteria mesenterica inferiore e l'arteria emorroidale superiore.
Figura 1.6
Punti deboli della vascolarizzazione mesenterica
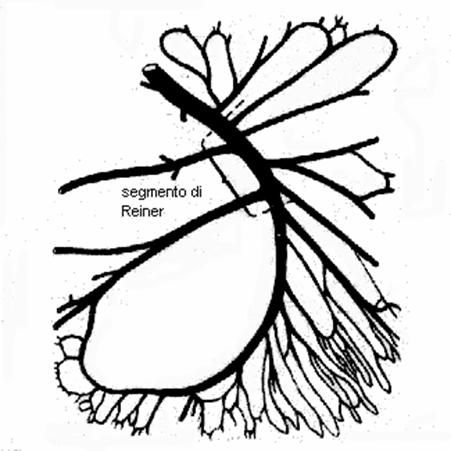
Il punto di Reiner è costituito da un segmento dell'arteria mesenterica superiore, compreso fra il punto situato a monte dell'origine della seconda arteria intestinale e della colica media ed un punto a valle dell'ileocolica.
Figura 1.7
Segmento di Reiner
Capitolo 2
EZIOLOGIA
L'eziologia dell'ischemia mesenterica acuta può essere schematizzata in quattrro categorie comprendenti: embolie e trombosi arteriose, trombosi venose, cause funzionali.
2.1 EMBOLIA ARTERIOSA
E' la causa più frequente, rappresentando il 50% dei casi.
La maggior parte degli emboli origina da trombi delle cavità cardiache di sinistra o da lesioni valvolari. I trombi sono a loro volta dovuti ad aritmie (fibrillazione atriale) o alla presenza di aree discinetiche successive ad infarto miocardico o ad altre affezioni cardiache (cardiomiopatie dilatative).
Circa il 15% degli emboli si arresta all'origine dell'arteria mesenterica superiore, ma la maggior parte si colloca a 3-10 cm da tale punto, poco oltre l'origine dell'arteria colica media. Quasi sempre vi è concomitante embolizzazione di altri distretti arteriosi.
2.2 TROMBOSI ARTERIOSA
E' responsabile del 25% dei casi.
E' solitamente associata a lesioni aterosclerotiche. Molti pazienti lamentano una storia di ischemia cronica, con dolore post-prandiale (angina abdominis), perdita di peso e sazietà precoce.
La lesione ateromasica progredisce lentamente negli anni, fino al raggiungimento di un limite critico di stenosi. A questo punto, è sufficiente una riduzione del flusso per favorire l'improvvisa trombizzazione della parte del
lume rimasta pervia.
Generalmente, la trombosi arteriosa mesenterica si verifica all'origine dei vasi.
Tabella 2.1
Classificazione eziologica dell'infarto intestinale da ostruzione arteriosa
Embolica: - infarto miocardico
- fibrillazione atriale
- endocardite vegetante
- miocardite
- anomalie congenite
- chirurgia cardiaca
- aneurismi ed ateromasia dell'aorta toracica
Trombotica: - aterosclerosi
- ipercoagulabilità sanguigna
- arteriopatie rare: luetica, settica, panarterite nodosa, arteriti
2.3 TROMBOSI VENOSA
Descritta per la prima volta da Elliott nel 1895 come «trombosi del sistema venoso porto-mesenterico», costituisce una rara evenienza, stimata intorno al 5-15%. Il tasso di mortalità a lungo termine risulta particolarmente elevato, pari a 83%.
Vi può essere interessamento diretto della vena mesenterica superiore o in conseguenza di ostruzione portale. Inoltre si distinguono forme primitive, idiopatiche, da forme secondarie a varie affezioni, sistemiche o locali.
L'occlusione venosa si traduce in una stasi ematica che impedisce il flusso
arterioso e provoca congestione capillare, emorragia sottomucosa ed infarto intestinale.
Tabella 2.2
Classificazione eziologica dell'infarto intestinale da ostruzione venosa
Cause locali:
- tromboflebiti tronculari (discendenti): - cirrosi epatica
- epatite luetica
- splenomegalie croniche e
tromboflebitiche
- pileflebite suppurativa
- tromboflebiti radicolari (ascendenti): - appendicite acuta
- enterite ulcerosa
- colite tipica
- diverticolite
- tumori intestinali ulcerati
- parassitosi intestinali
- affezioni flogistiche
(vie biliari, pancreas, apparato
uro-genitale ecc.)
- tumori dell'apparato genitale
femminile
- traumi chirurgici
Cause generali:
- setticemia
- piemia
- flebiti di altri distretti
- polmoniti
- ipercoagulabilità ematica (piastrinosi post-splenectomia, deficit di
antitrombina III ereditario o secondario ad uso di estro-progestinici )
2.4 ISCHEMIA «FUNZIONALE»
E' la conseguenza di un deficit di flusso a cui fa seguito vasocostrizione mesenterica.
Si verifica in seguito a deficit della pompa cardiaca, shock, emoconcentrazione, somministrazione di farmaci e sostanze ad azione vasocostrittiva (digitale, cocaina ecc.) e può complicare, come sarà detto più avanti, interventi cardiochirurgici.
Scoperta per la prima volta 30 anni fa, la sua incidenza è oggi in diminuzione, grazie all'evoluzione dei presidi terapeutici e rianimatori cardiovascolari.
2.5 FORME MISTE
Accanto alle quattro forme eziologiche riportate, vanno ricordati i casi di infarto misto, arterioso e venoso.
Tabella 2.3
Classificazione eziologica dell'infarto intestinale da forme miste
- briglie aderenziali
- periviscerite
- adenopatie mesenteriche
- ernie
- volvoli
- invaginazioni
- tumori e cisti di mesentere, pancreas, stomaco, colon trasverso, fegato ecc.
Capitolo 3
FISIOPATOLOGIA
3.1 EVOLUZIONE DEL DANNO ISCHEMICO
Indipendentemente dall'agente eziologico, la riduzione della perfusione tissutale a livelli critici rappresenta il momento essenziale che innesca la sequenza evolutiva verso la necrosi. All'ischemia, infatti, fanno seguito alterazioni regressive della mucosa con perdita di liquidi, elettroliti e plasma nel lume del viscere, e conseguente ipovolemia. La rottura della barriera mucosa intestinale, accelerata dalla presenza di enzimi proteolitici endoluminali, provoca un sequestro di volume plasmatico in addome (aggravando l'ipovolemia) e permette il passaggio di batteri anaerobi nel sistema portale, con conseguente produzione di endotossine.
Modificazioni ultrastrutturali degli enterociti sono già apprezzabili entro 10 minuti dall'insulto ischemico ed il danno mitocondriale determina la conversione del metabolismo da aerobio ad anaerobio, provocando acidosi metabolica. Inoltre, a seguito dell'anossia, si liberano polipeptidi ad azione inotropa negativa (MDF: myocardial depressant factor) ed idrolasi lisosomiali, con conseguente vasocostrizione splancnica marcata ed ulteriore aggravamento dell'ischemia.
Un'altra conseguenza dello sfaldamento dell'epitelio è il rilascio di serotonina, la quale contribuisce, insieme ad altre sostanze agenti sulla coagulazione e a tossine batteriche, al meccanismo di coagulazione intravasale disseminata (CID).
L'ipovolemia, l'acidosi metabolica, l'azione dei fattori miocardiodepressori ed il
rilascio di prostaglandine sono tutte cause responsabili della genesi dello shock, quadro tardivo che rende la prognosi infausta.
3.2 ESTENSIONE DEL DANNO
La sede dell'ostruzione condiziona l'estensione dell'infarto.
Ad esempio, in caso di ostruzione dell'arteria mesenterica superiore in corrispondenza del segmento di Reiner, si verifica l'interessamento del colon destro e del tenue dal Treitz in poi.
Figura 3.1
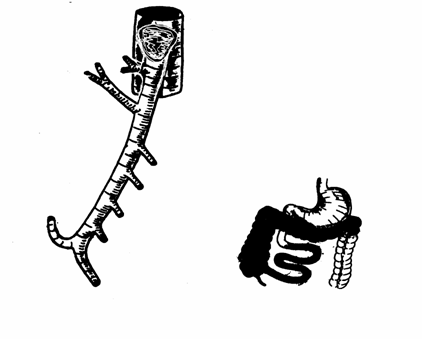
Estensione del danno ischemico per ostruzioni a
livello del segmento di Reiner
Se l'ostruzione avviene sotto l'origine dell'arteria colica media, viene risparmiato il digiuno prossimale ma vengono coinvolti il cieco, parte dell'ascendente e la restante parte del tenue.
Per ostruzioni nel punto di emergenza dell'arteria ileocolica si verifica l'interessamento dell'ileo e del cieco.
Figura 3.2
Estensione del danno ischemico per ostruzioni a livello dell'arteria ileocolica

Un'ostruzione al di sotto dell'arteria ileocolica è responsabile di ischemia-infarto di segmenti del tenue.
Capitolo 4
QUADRO ANATOMO-PATOLOGICO
Macroscopicamente, nelle fasi iniziali, l'intestino appare pallido e contratto per spasmo.
In seguito, compaiono marcata congestione e dilatazione vascolare e la sierosa si opacizza, assumendo un colorito rosso scuro o bruno, con essudato fibrinoso. All'interno del lume è contenuto materiale muco-ematico o francamente ematico. La mucosa presenta ulcere serpiginose, estese anche alla sottomucosa. Lo strato muscolare è assottigliato. Si possono inoltre osservare eventuali segni di perforazione.
Istologicamente, le lesioni compaiono dapprima alla mucosa, per poi estendersi tardivamente fino alla sierosa, e sono caratterizzate da necrosi degli enterociti, con distruzione della membrana basale ed infiltrazione emorragica della lamina propria. Vi è marcata dilatazione dei capillari.
Tardivamente, si instaura la necrosi totale della mucosa. Nel tessuto necrotico sono presenti colonie batteriche e polimorfonucleati neutrofili.
La sottomucosa si presenta edematosa ed emorragica.
Le caratteristiche istologiche della muscolare appaiono indistinte e, in seguito, la necrosi può estendersi anche a tale zona.
Capitolo 5
QUADRO CLINICO-LABORATORISTICO
Non esiste un quadro clinico patognomonico dell'infarto intestinale, e questo rende conto del ritardo con cui si giunge alla diagnosi nella maggior parte dei casi.
La sintomatologia passa, in genere, attraverso tre fasi evolutive. Una prima fase è caratterizzata da un dato clinico suggestivo e cioè la presenza di «addome acuto senza addome acuto», che sottolinea la discordanza tra l'acuzie della sintomatologia e la negatività dell'obiettività addominale. In questo stadio non vi è contrattura di difesa, nè distensione, e l'attività peristaltica è aumentata. Il paziente può presentare nausea, vomito, diarrea, emoconcentrazione, associati a stato d'ansia, ma nel complesso le condizioni generali appaiono ancora buone.
Dopo 2-3 ore si passa ad una fase «paralitica» della durata di 12-24 ore: si attenuano i dolori dovuti agli spasmi intestinali, ma le lesioni evolvono, l'addome inizia a distendersi progressivamente ed il laboratorio mostra aumento della fosfatasemia, leucocitosi ed acidosi metabolica.
La fase successiva è caratterizzata dalla necrosi di parete, con assenza di peristalsi, comparsa del quadro peritonitico fino al quadro dello shock. A questo punto, anche l'intervento chirurgico non ha possibilità di successo (la mortalità operatoria supera l'80% nelle forme arteriose ed è di poco inferiore nelle altre forme).
Tabella 5.1
Principali sintomi e segni nell'ischemia-infarto intestinale
Dolore addominale 83%
Anoressia 53%
Diarrea 43%
Stipsi 13%
Nausea/vomito 42%
Febbre 25%
Distensione addominale 51%
Tensione addominale 36%
Ascite 5%
Ipotensione 6%
Tachicardia 21%
Da quanto è stato detto, anche il quadro bioumorale risulta altamente aspecifico e molte alterazioni insorgono tardivamente. Esso comprende:
- leucocitosi;
- acidosi metabolica con persistente deficit di basi;
- aumento dell'ematocrito per emoconcentrazione;
- ipoalbuminemia;
- aumento dei fosfati sierici.
In alcuni pazienti si può verificare un aumento di amilasi, LDH, CPK, fosfatasi alcalina.
L'esame del fluido peritoneale, ottenuto mediante paracentesi, permette la conta leucocitaria, la ricerca di batteri, la rilevazione dell'aumento di fosfati, LDH, fosfatasi alcalina, acido lattico. Tuttavia tale procedura non riscuote grandi consensi.
Alcuni Autori hanno posto l'attenzione sull'elevazione dei livelli di D-Lattato sierico come marcatore specifico. Prodotto dalla flora batterica intestinale, il
D-Lattato aumenta in conseguenza del danno ischemico, poichè la crescita batterica risulta aumentata. Tuttavia, l'elevazione di tale marcatore si verifica anche in altre affezioni causanti addome acuto, come nel caso dell'occlusione intestinale.
Capitolo 6
DIAGNOSTICA STRUMENTALE
6.1 RADIOGRAFIA ADDOMINALE
L'esame radiografico dell'addome, eseguito in orto e clinostatismo, in genere non è diagnostico, ma si limita ad indurre il sospetto di patologia ischemica acuta intestinale e a porla in diagnosi differenziale con altre condizioni morbose. E' necessario, pertanto, che sia supportato da altri esami strumentali.
Nella maggior parte dei casi, diviene positivo solo quando compaiono le alterazioni più gravi e rivela per lo più segni aspecifici. A seconda della fase è possibile infatti osservare:
- addome povero di gas;
- scarsità di gas colico e distensione gassosa del tenue;
- edema della mucosa nel contesto di anse distese da gas;
- immagini ad impronta di pollice;
- ispessimento delle pliche e delle pareti intestinali;
- fissità delle anse;
- salto della flessura splenica.
Maggiore specificità è affidata ai reperti di pneumatosi parietale e presenza di gas nel sistema portale, la cui comparsa è però tardiva.
L'esame radiografico può risultare positivo in presenza di TC negativa o aspecifica, ma solitamente ha sensibilità inferiore nell'evidenziare i segni dell'ischemia.
Tabella 6.1
TC e radiografia standard: sensibilità a confronto.
RX TC
distensione intestinale 43% 70-71%
pneumatosi 4-29% 30-57%
gas libero addominale 0% 7%
gas portale 0-14% 13-36%
6.2 ANGIOGRAFIA
L'angiografia, pur rappresentando, almeno in linea teorica, l'indagine più utile nella diagnosi precoce di ischemia intestinale, presenta alcuni limiti (invasività, complessità organizzativa, costo elevato) che ne impediscono l'impiego routinario.
Un altro grave limite è posto dall'aspecificità del quadro clinico in questione: l'esecuzione di un'angiografia al minimo sospetto, comporterebbe una percentuale di esami negativi del 10-50%.
Durante l'esame, sono necessarie le proiezioni anteroposteriore e laterale, per meglio identificare i vasi a rischio: le origini del tronco celiaco e dell'arteria mesenterica superiore possono essere visualizzate solo in proiezione laterale, mentre i loro tratti più distali sono meglio osservati in quella anteroposteriore. Spesso occorre l' incannulamento selettivo dei vasi in esame, per definire con maggior chiarezza il quadro anatomico e fisiopatologico.
In caso di embolizzazione dell'arteria mesenterica superiore, gli emboli si arrestano frequentemente a 3-10 cm dall'origine del vaso, distalmente all'origine
dell'arteria colica media. Nel punto di occlusione è possibile apprezzare un'immagine «a menisco».
La trombosi sintomatica dell'arteria mesenterica superiore è in genere associata ad un elevato grado di stenosi dell'asse celiaco.
In presenza di ischemia «funzionale», l'angiografia rivela la presenza di aree multiple di restringimento ed irregolarità nelle branche maggiori, mentre le piccole e medie branche sono poco o per nulla visibili.
Sono stati postulati quattro criteri arteriografici per la diagnosi di vasospasmo mesenterico (Siegelman et al.):
1) Restringimento all'origine di più rami dell'arteria mesenterica superiore.
2) Alternanza di dilatazioni e stenosi dei rami intestinali.
3) Spasmo delle arcate mesenteriche.
4) Difetti di riempimento dei vasi intramurali.
Nella trombosi venosa, l'angiografia selettiva può mettere in evidenza il reflusso di mezzo di contrasto in aorta, dovuto ad un flusso estremamente basso per l'elevata resistenza opposta dal distretto venoso. E' anche caratteristico il prolungamento della fase arteriosa, con accumulo di contrasto ed ispessimento delle pareti intestinali. In casi estremi, uno stravaso di mezzo di contrasto all'interno del lume intestinale può essere indicativo di sanguinamento in atto.
La diagnosi angiografica definitiva di trombosi venosa mesenterica viene formulata durante la fase venosa, in cui risalta un difetto di riempimento dei vasi portali interessati e, nei casi più estremi di trombosi massiva, è assente l'intera fase venosa.
L'angiografia nell'ischemia mesenterica non ricopre solo un ruolo diagnostico, ma si presta anche ad interventi terapeutici, atti a migliorarne il decorso e la prognosi: attraverso il catetere utilizzato per l'esame, è possibile l'infusione di farmaci trombolitici ed anticoagulanti (urokinasi, streptokinasi, eparina) in caso di tromboembolia, vasodilatatori (papaverina) in caso di ischemia «funzionale».
6.3 TOMOGRAFIA COMPUTERIZZATA
L'elevato tasso di mortalità correlato ai casi di ischemia mesenterica acuta è da attribuirsi, soprattutto, al ritardo con cui si giunge alla diagnosi, a causa dell'aspecificità del quadro clinico-laboratoristico e dei limiti degli esami strumentali descritti precedentemente. Ne deriva l'importanza dell'introduzione di metodiche non invasive e che consentano, con discreta accuratezza, un inquadramento precoce della malattia ed una adeguata diagnosi differenziale. Diversi studi hanno dimostrato che la TC possiede tali requisiti.
I reperti da ricercare con la TC sono molteplici:
Occlusione dei vasi splancnici. La trombosi vasale è ben identificabile con la TC se localizzata ai tronchi principali, mentre diviene di difficile dimostrazione se interessa i rami segmentari. Un trombo recente può anche essere identificato all'esame TC diretto, risultando non di rado lievemente iperdenso, specie nelle forme venose. Spesso risulta tuttavia isodenso e quindi visibile, tramite mdc endovena, come un difetto di riempimento privo di enhancement. Secondo alcuni Autori, nelle trombosi venose è possibile riscontrare un'iperdensità della parete vasale, dovuta ad opacizzazione dei vasa vasorum da parte del mezzo di contrasto. L'interessamento della vena mesenterica superiore, inoltre, è spesso associato a trombosi della vena porta e/o della splenica, ma, nella metà dei casi, non si sviluppa un infarto a causa dei circoli collaterali che si creano.
Nelle forme arteriose, l'occlusione dei primi 2 cm dell'arteria mesenterica superiore indica in genere la natura trombotica, mentre la natura embolica è associata alla presenza di un tratto prossimale integro e di un successivo ostacolo.
Alcuni reperti possono orientare, in via del tutto presuntiva, verso la distinzione tra ischemia arteriosa e venosa: nelle forme venose, l'ispessimento del
mesentere e della parete intestinale è più marcato ed il limite tra anse ischemiche
e anse sane è meno netto.
Tuttavia, il reperto TC di occlusione vasale è riportato con bassa frequenza dalla letteratura: in realtà si tratta di una sottostima legata a vari fattori (contributi non recenti, carenza d'uso di apparecchiature moderne ecc.).
Dilatazione intestinale. Viene ritenuto tale un diametro superiore a 2.5 cm per le anse del tenue e superiore a 8 cm per le anse del colon.
Le anse sovradistese possono avere contenuto prevalentemente gassoso o liquido o misto. Caratteristica è la distensione liquida, espressione dell'essudazione intraluminale di sangue e liquidi ad elevato tasso elettrolitico: non di rado si assiste alla presenza di materiale avente densità non omogenea o «marezzato».
Pneumatosi intestinale. E' la presenza di accumuli di gas all'interno della parete. Questi possono avere disposizione diversa: lineare, curvilinea, cistica. Talora le bolle si localizzano nella parte centrale della parete, assumendo una disposizione a raggiera e ciò viene descritto come «segno del kiwi».
La pneumatosi intramurale è espressione di una fase più avanzata rispetto all'ispessimento parietale.
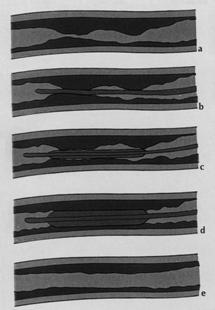
Ispessimento della parete intestinale. Si osserva se la parete del tenue e/o colon supera i 3 mm di spessore. L'ispessimento è ritenuto segmentario se lo spessore parietale è maggiore di 2 mm rispetto a quello dei tratti adiacenti. Le pareti ispessite possono avere una densità omogenea e risultare ipodense rispetto alle anse normali o possono avere aspetto stratificato, con uno strato interno ipodenso, dovuto all'edema della sottomucosa, ed uno strato esterno iperdenso, dovuto alla ipervascolarizzazione della muscolare. Tale segno, detto «del doppio alone», è visibile in 1 caso su 5.
Più raro è invece il «segno del bersaglio», in cui la parete ha aspetto tristratificato.
Ridotto enhancement diffuso o focale della parete ispessita. Si può osservare prendendo in considerazione segmenti intestinali adeguatamente distesi e privi di pneumatosi, e confrontando le sezioni eseguite prima e dopo la somministrazione di mezzo di contrasto.
Aumentato enhancement della parete ispessita. Ha valenza soggettiva.
Ostruzione meccanica. E' diagnosticata in presenza di una zona ben definita di transizione tra anse dilatate prossimalmente ed anse collabite distalmente.
Edema mesenterico. Il mesentere appare tumefatto, iperemico, con evidenza dell'aumento, in numero e dimensioni, di formazioni vasali congeste e trombotiche (aspetto stellato).
La TC mostra un diffuso incremento dell'attenuazione del mesentere.
Ascite. Comprendendo una componente corpuscolare, alla TC presenta spesso una densità leggermente superiore a quella dell'acqua.
Gas portale. Il gas fornisce un'eccellente risoluzione di contrasto, permettendo di individuare anche l'embolia gassosa di altri distretti vascolari.
Pneumoretroperitoneo. Secondo alcuni Autori, questo segno, fino ad ora non riportato dalla letteratura, potrebbe essere inserito fra i reperti TC utili alla diagnosi di infarto intestinale.
Infarto di altri organi.
6.3.1 FATTORI DI RISCHIO E PROGNOSTICI ALL'ESAME TC
Nonostante una così vasta gamma di segni, la diagnosi di ischemia mesenterica non risulta sempre agevole. Ciò è spiegato dal fatto che non tutti i segni sono presenti contemporaneamente, ma in momenti diversi, e alcuni sono addirittura tardivi e prognosticamente sfavorevoli.
Tabella 6.2
Uno studio effettuato su 39 casi e 24 controlli (Taourel et al.) ha fornito i
seguenti risultati:
Reperti TC Gruppo «studio» Gruppo «controllo» Sensibilità Specificità Accuratezza
(%) (%) (%) (%) (%)
Trombosi AMS 7 0 18 100 49
Trombosi VMS 6 0 15 100 48
Gas intramurale 11 1 28 96 54
Gas portale 2 0 5 100 41
Dilatazione anse 26 17 67 29 52
Ostruzione 4 16 10 33 19
Enhancement aumentato 13 7 33 71 48
Enhancement ridotto 7 1 18 96 48
Ispessimento di parete 15 8 38 67 49
Edema mesenterico 27 15 69 28 57
Ascite 19 7 49 71 57
Ischemia in altri organi 7 0 18 100 49
Per la diagnosi di ishemia mesenterica acuta, ciascuno dei seguenti reperti ha una specificità superiore al 95% ed una sensibilità inferiore al 30%:
- trombosi arteriosa o venosa;
- gas intramurale;
- gas nel sistema portale;
- diminuzione focale dell'enhancement della parete intestinale;
- infarto di altri organi (fegato, milza).
Quando, come criterio per la diagnosi, è usato almeno uno di questi elementi, la TC ha una sensibilità del 64% ed una specificità del 92%, con un'accuratezza pari al 75%.
Inoltre, correlando i segni TC con la sopravvivenza, si è osservato che sono fattori prognostici statisticamente poco favorevoli sono: trombosi dell'arteria mesenterica superiore ed infarto di altri organi, mentre più favorevole è la presenza di: trombosi della vena mesenterica superiore, ispessimento di parete, aumentato enhancement della parete.
Tabella 6.3
Correlazione fra segni TC e sopravvivenza
Reperto TC Casi Sopravvissuti Deceduti
Trombosi AMS 7 0 7
Trombosi VMS 6 6 0
Gas intramurale 11 3 8
Gas portale 2 1 1
Dilatazione intestinale 26 13 13
Ostruzione intestinale 4 2 2
Ispessimento di parete 15 11 4
Aumentato enhancement 13 10 3
Diminuito enhancement 7 2 5
Edema mesenterico 27 14 13
Ascite 19 12 7
Infarto di altri organi 7 1 6
E' tuttavia doveroso sottolineare in tale studio una sottostima del numero di pazienti con occlusione arteriosa splancnica, il che spiegherebbe il valore prognostico negativo attribuito a tale segno.
Altri studi sottolineano la presenza del gas portale quale indice di grave
evoluzione prognostica, con indici di mortalità elevati (pari al 75-85%).
Alcuni Autori (Rossi et al.) sostengono, come accennato in precedenza, l'importanza per il futuro del reperto di pneumoretroperitoneo. Da uno studio retrospettivo da essi condotto su 60 pazienti con diagnosi confermata di infarto intestinale, è stato riscontrato pneumoretroperitoneo in 5 casi (8.5%).
6.4 ALTRE INDAGINI STRUMENTALI
6.4.1 ECO-COLOR-DOPPLER
L'esame ultrasonografico presenta alcuni vantaggi, richiedendo brevi tempi di esecuzione, non essendo invasivo, non necessitando di mezzo di contrasto e risultando facilmente attuabile, al punto da essere ritenuto da alcuni Autori una procedura di primo livello. Tuttavia risulta spesso ostacolato dalla presenza di anse distese e dalla pneumatosi, che rendono difficoltosa la visualizzazione dei vasi. Inoltre il contributo degli ultrasuoni risulta modesto in caso di ischemia «funzionale».
Dall'esame possono emergere i seguenti dati:
- Alto grado di stenosi del tronco celiaco: sospettato in presenza di un picco di velocità sistolica maggiore di 1.50-2.00 m/sec. all'ostio dei vasi.
- Alto grado di stenosi dell'arteria mesenterica superiore: se picco di velocità sistolica superiore a 3 m/sec.
- Occlusione dei vasi splancnici: in assenza di segnale di «colore» o di «pulsato», con inversione di flusso.
E' possibile anche una valutazione di:
- ispessimento della parete intestinale;
- perdita della stratificazione della parete;
- aumento o riduzione della peristalsi;
- dilatazione delle anse;
- presenza di gas portale.
L'esame endoscopico, fino ad oggi, non ha riscosso grandi consensi nella diagnosi di ischemia-infarto intestinale. Infatti, pur trovando impiego nella valutazione di pazienti con sospetto di ischemia del colon, non si presta alla valutazione degli altri segmenti, inaccessibili all'endoscopio. Inoltre, presenta alcuni fattori di rischio in grado di provocare complicanze ed aggravare il quadro clinico. Durante la procedura, infatti, l'insufflazione può esacerbare l'ischemia o perforare una parete già di per sè compromessa.
Boley e collaboratori hanno dimostrato che l'insufflazione di aria a pressioni superiori a 30 mmHg può determinare una diminuzione del flusso intestinale. Per ovviare a ciò, viene proposta l'insufflazione di CO2, gas rapidamente assorbito, che ridurrebbe il pericolo di distensione.
Molti sono d'accordo sul fatto che, per una migliore distinzione tra anse sane ed ischemiche, l'endoscopia possa essere supportata da altre procedure, quali la somministrazione di fluoresceina e l'uso della flussimetria con laser Doppler, tecnica che però è ancora in fase di studio.
La colonscopia, come è già stato detto, trova impiego nella diagnosi di «colite ischemica», e può essere utile nella decisione di effettuare o meno una laparotomia.
I segni di più frequente riscontro nella mucosa sono:
- petecchie;
- pallore;
- iperemia;
- essudazione;
- lesioni ulcerative-necrosi.
6.4.3 ANGIOGRAFIA A RISONANZA MAGNETICA
Secondo alcuni Autori, tale indagine potrebbe divenire in futuro uno strumento di primo piano per la diagnosi di ischemia mesenterica acuta e cronica, essendo essa non invasiva e potendo fornire informazioni riguardanti il grado di compromissione dei vasi mesenterici, ma anche informazioni su flusso e saturazione di ossigeno nei distretti in esame (sfruttando le differenze di risonanza ed i diversi tempi di rilassamento tra deossi ed ossiemoglobina). E' risaputo, infatti, che, diminuendo il flusso intestinale, aumenta l'estrazione di ossigeno. Quando, per ulteriori diminuzioni del flusso, l'estrazione diviene insufficiente, si verifica l'insorgenza del danno ischemico.
I risultati di studi condotti su modelli canini dimostrano che la sola misurazione del flusso risulta insufficiente per la diagnosi di ischemia mesenterica acuta, ma la sensibilità aumenta se si associa l'ossimetria RM.
La diminuzione della saturazione di ossigeno misurata nella vena mesenterica superiore è correlata al grado di diminuzione del flusso nell'arteria mesenterica superiore. Secondo una curva a profilo sigmoidale, ad iniziali diminuzioni del flusso nell'arteria mesenterica superiore, corrispondono soltanto modeste riduzioni della saturazione di ossigeno nella vena mesenterica superiore (probabilmente per la presenza di circoli collaterali). Quando il flusso diminuisce ulteriormente nell'arteria, si riduce anche nella vena e, con esso, viene scemando l'estrazione di ossigeno: di conseguenza, la misurazione tramite
RM della saturazione di ossigeno nella vena mesenterica superiore presenta buona accuratezza e sensibilità.
Capitolo 7
STRATEGIE TERAPEUTICHE NELL'ISCHEMIA E
NELL' INFARTO ARTERIOSO
Prevedono l'attuazione di:
- terapia medica in tutti i pazienti;
- terapia angioradiologica in un numero altamente selezionato di casi;
- terapia chirurgica nella maggior parte dei casi.
7.1 TERAPIA MEDICA
L'approccio terapeutico iniziale deve provvedere, innanzitutto, al sostegno delle funzioni vitali, le quali possono essere alterate a causa delle sequele della malattia ischemica intestinale, o di una condizione morbosa di base da cui essa ha avuto origine. Occorre inoltre:
- sedazione del dolore (es.: pentazocina 30 mg intramuscolo ogni 4-6 ore);
- correzione dello scompenso idroelettrolitico (1000 ml di soluzione fisiologica o polisalina, con aggiunta di potassio cloruro 30 mEq ogni 12 ore);
- correzione degli squlibri acido-base;
- terapia antibiotica a largo spettro (es.: ceftazidime 2 g ogni 12 ore endovena, oppure ceftriaxone 1 g ogni 12 ore intramuscolo, oppure imipenem-cilastatina sodica 1 g ogni 12 ore in associazione a teicoplanina 200 mg ogni 12 ore endovena.).
- terapia anticoagulante e trombolitica per via sistemica.
- posizionamento di un sondino naso-gastrico a scopo decompressivo e per ridurre il rischio di aspirazione di materiale gastrico.
7.2 TERAPIA ANGIORADIOLOGICA
Tale metodica consiste nell'infusione loco-regionale di farmaci, mediante cateterizzazione con tecnica di Seldinger (puntura dell'arteria, introduzione, attraverso l'ago, di una guida metallica e successivamente del catetere che viene guidato fino all'arteria interessata dopo aver ritirato la guida). La tecnica è la stessa utilizzata per l'esecuzione dell'esame angiografico.
In un numero altamente selezionato di pazienti con diagnosi precoce di ostruzione trombo-embolica dell'arteria mesenterica superiore, in assenza di necrosi intestinale, è possibile somministrare farmaci trombolitici ed anticoagulanti: alcuni propongono l'infusione iniziale di 250.000 UI di urokinasi, attraverso il catetere, in un'ora, seguita da 120.000 UI/ora per 8 ore, associata a somministrazione di 6000 U/ora di eparina.
La terapia trombolitica deve essere strettamente limitata ai pazienti nei quali l'insorgenza del dolore addominale precede la diagnosi di 8 ore al massimo, in assenza di segni di interessamento peritoneale. Se non si ottiene miglioramento del quadro dopo 4 ore di terapia o si sviluppa irritazione peritoneale, il trattamento deve essere interrotto e deve essere eseguita una laparotomia d'urgenza.
In caso di ischemia intestinale non occlusiva, l'approccio terapeutico prevede l'infusione di farmaci vasodilatatori quali tolazolina e papaverina. Quest'ultima viene somministrata alle dosi di 30-60 mg/ora, per almeno 24 ore. In caso di miglioramento del quadro, deve essere eseguita un'angiografia dopo 30 minuti sfruttando lo stesso catetere; in caso di non risoluzione o peggioramento del quadro, con interessamento peritoneale, è indicato l'intervento chirurgico d'urgenza, pur continuando l'infusione di papaverina durante e dopo la seduta operatoria.
Per prevenire l'insorgenza di fenomeni tromboembolici durante un'ischemia non occlusiva e per impedire la trombizzazione del vaso incannulato, è importante
somministrare eparina attraverso una vena periferica, ma è da proscriverne l'infusione locale, per evitare la precipitazione con la papaverina. E' necessaria inoltre l'interruzione di eventuali farmaci ad azione vasocostrittiva.
Prima di rimuovere il catetere è buona norma, interrotta la terapia con papaverina, infondere una soluzione salina per 30-60 minuti, seguita da angiografia per verificare la risoluzione della vasocostrizione.
Durante il trattamento, è fondamentale il monitoraggio dello stato emodinamico del paziente: in caso di spostamento del catetere in aorta, la papaverina viene infusa a livello sistemico, con il rischio di marcata ipotensione. In questo caso, occorre interrompere il trattamento, infondere soluzione salina e verificare, mediante esame radiografico, la posizione del catetere.
In conclusione, la metodica angioradiologica ricopre un ruolo non indifferente nel trattamento dell'ischemia mesenterica acuta, specie in quella non occlusiva e, secondo alcuni Autori, talora permette di evitare l'intervento chirurgico. Tuttavia presenta alcuni limiti, come il fatto di proporsi come alternativa all'intervento solo nelle fasi iniziali del processo morboso e spesso la laparotomia è comunque inevitabile. Inoltre, resta una procedura invasiva e non scevra da rischi (dissezione di placche causate dal catetere, ematoma in sede di introduzione, reazioni da farmaci).
7.3 TERAPIA CHIRURGICA
L'intervento chirurgico, che deve essere effettuato precocemente in presenza di interessamento peritoneale, rappresenta il cardine della terapia dell'ischemia-infarto intestinale. Talora può seguire una terapia angioradiologica gravata da insuccesso. Inoltre, è un utile mezzo nell'eventuale controllo, a distanza di tempo, del successo terapeutico (il cosiddetto «second look»).
Dopo aver eseguito un'ampia laparotomia mediana, occorre:
- localizzare i vasi ostruiti;
- ripristinare il flusso, mediante tecniche di rivascolarizzazione;
- esprimere un giudizio sulla vitalità delle anse;
- effettuare la resezione delle anse necrotiche.
7.3.1 TECNICHE DI RIVASCOLARIZZAZIONE
tabella 7.1
Rivascolarizzazione
Diretta: 1) Embolectomia con Fogarty
2) Tromboendoarteriectomia ( TEA)
3) Angioplastica transluminale
4) By-pass/reimpianto
Indiretta: 1) Splancnicectomia
2) Sezione del legamento arcuato
3) Avventiziectomia
Embolectomia.
Come altre tecniche, ha lo scopo di ripristinare il flusso dopo occlusioni arteriose acute, per prevenire o minimizzare l'infarto.
E' fondamentale la diagnosi differenziale tra embolia e trombosi per una corretta strategia operatoria: se l'occlusione è di origine embolica, l'embolectomia è spesso sufficiente. Se invece si instaura una trombosi e questa si sovrappone ad una preesistente lesione aterosclerotica, occorre un trattamento di by-pass o angioplastica transluminale o tromboendoarteriectomia.
Nell'embolectomia occorre:
- localizzare l'arteria ed il punto di occlusione. Se la causa di occlusione è un
embolo, in genere vi è pulsazione prossimalmente ad esso. Può essere utile
l'uso intraoperatorio dell'eco-color-doppler;
- mobilizzare l'arteria a livello dell'ostruzione o più distalmente;
- effettuare un'arteriotomia trasversale al fine di prevenire la stenosi del vaso al momento della sutura;
- inserire un catetere tipo «Fogarty» e, dopo gonfiaggio del palloncino, estrarre il materiale tromboembolico. L'embolectomia può essere distale o prossimale ed utilizzare rispettivamente Fogarty 3 e 4. (Fig.7.1)
Tromboendoarteriectomia (TEA).
Consiste nella rimozione della placca ateromasica obliterante e degli strati interni della parete arteriosa. Quest'ultima nella malattia aterosclerotica presenta una zona interna (core) alterata dal processo morboso, ed una più esterna non coinvolta. Si crea in tal modo un piano di clivaggio che viene identificato nello spessore della tunica media, all'interno della membrana elastica esterna.
La tecnica prevede:
- esecuzione di un'arteriotomia longitudinale condotta oltre l'estremità della placca;
- rimozione del cilindro ostruente, comprese la tonaca intima e parte della media;
- sutura del vaso mediante interposizione di un «patch» sintetico o venoso autologo per prevenire fenomeni stenotici.
Figura 7.1
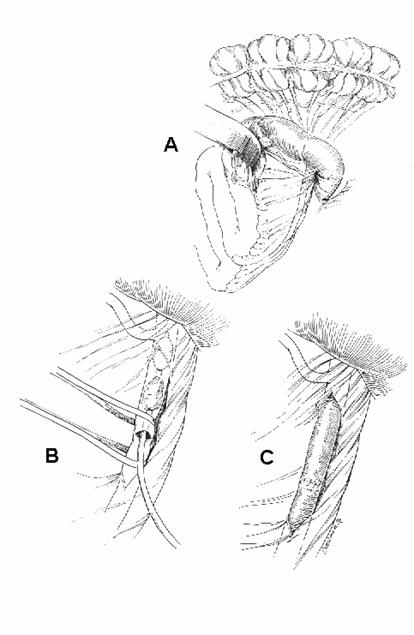
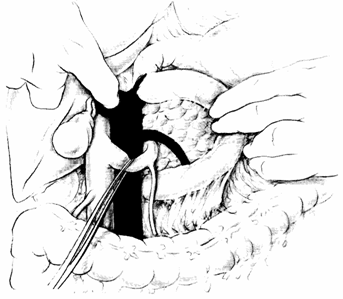
Embolectomia
A) Esposizione dell'arteria mesenterica superiore mediante mobilizzazione del colon trasverso e del duodeno.
B) Estrazione dell'embolo tramite Fogarty attraverso un'incisione trasversale dell'arteria mesenterica superiore.
C) Sutura del vaso.
Angioplastica transluminale percutanea.
Si può utilizzare per stenosi all'origine dell'arteria mesenterica superiore, in pazienti che sono cattivi candidati ad un intervento chirurgico protratto.
Consiste nell'introduzione intrarteriosa per via percutanea (attraverso l'arteria femorale), di un catetere a palloncino. Con l'ausilio di una guida, viene posizionato a livello della stenosi e viene gonfiato. Quest'ultimo, costituito da materiale rigido e non comprimibile (a differenza del Fogarty), deve essere sufficientemente lungo da coprire l'intera lesione, ed il gonfiaggio deve superare il calibro vasale del 10-20%.
L'effetto prodotto dalla dilatazione consiste in uno stiramento delle fibre elastiche e delle cellule della muscolare e in una frattura longitudinale delle tonache interne ammalate. Col tempo subentra una reazione di riparazione fibrosa e «neo-intimale».
La procedura permette inoltre l'eventuale applicazione di «stent». Questi sono sottili cilindri di acciaio o tantalio, a maglie larghe, capaci di venire espansi e di aderire alla parete vasale, garantendo la pervietà del lume. In tal modo, è possibile prevenire la recidiva delle stenosi, stimata intorno al 30%.
Occorre ricordare che l'angioplastica non è scevra da possibili complicanze:
- embolizzazione a distanza;
- dissezione del vaso;
- emorragia.
Interventi di by-pass e reimpianto.
Prevedono l'attuazione di pontaggi aorto-mesenterici tramite materiali protesici (dacron o politetrafluoroetilene) o vene autologhe, oppure il reimpianto diretto dell'arteria mesenterica superiore in aorta con l'ausilio di protesi.
Si effettuano per stenosi all'origine, e la scelta della tecnica da adottare varia a seconda dei vasi interessati. Spesso infatti, la lesione dell'arteria mesenterica superiore si associa alla compromissione del tronco celiaco, per cui si rende necessaria una duplice rivascolarizzazione.
Il by-pass può essere anterogrado o retrogrado.
Esempi:
By-pass anterogrado
Il pontaggio può avvenire tra l'aorta sopraceliaca e l'arteria mesenterica superiore, o comprendere anche il tronco celiaco. In quest'ultimo caso, è possibile utilizzare una protesi «biforcata».
Figura 7.2 Angioplastica transluminale percutanea
A - Steno-ostruzione arteriosa. B - Inserimento della guida. C - Introduzione, sulla stessa guida, del catetere a palloncino. D - Dilatazione del palloncino. E - Risultato finale.
Figura 7.3
Esempio di by-pass anterogrado
By-pass retrogrado
Il pontaggio può essere effettuato tra l'aorta sottorenale (o un'arteria iliaca) e l'arteria mesenterica superiore, utilizzando una protesi o una vena autologa.
Figura 7.4
Esempio di by-pass retrogrado
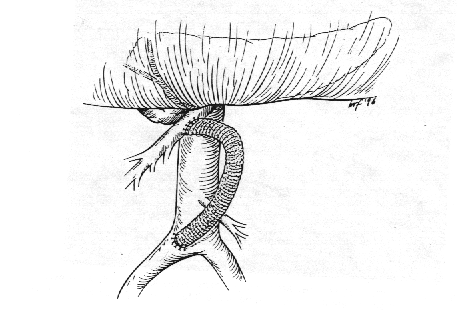
Figura 7.5
Accesso all'arteria mesenterica superiore
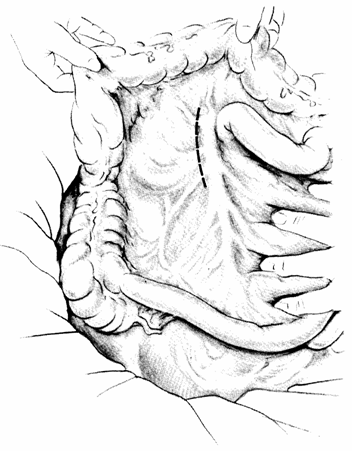
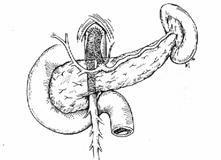
L'accesso più semplice all'arteria mesenterica superiore si effettua per via sotto e preduodenale. Con la trazione del colon e del mesocolon trasverso verso l'alto e del mesentere verso il basso, si identifica l'arteria come un cordone e si incide il peritoneo in corrispondenza.
Tratto con modifiche da: Encyclopédie Médico-Chirurgicale (Paris) 43-105 - 40-492.
Figura 7.6
Accesso all'arteria mesenterica superiore
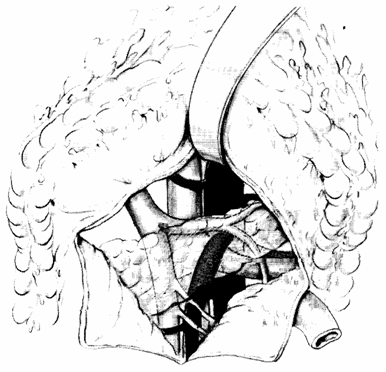
Un accesso molto conveniente all'arteria mesenterica superiore è quello inter-duodeno-pancreatico. I punti di repere anatomico circostanti sono la vena porta, la vena splenica, l'aorta, la vena mesenterica superiore e inferiore, la vena renale sinistra e l'angolo duodeno digiunale.
Tratto con modifiche da: Encyclopédie Médico-Chirurgicale (Paris) 43-105 - 40-492.
Figura 7.7
Accesso all'arteria mesenterica superiore
Un ulteriore accesso all'arteria mesenterica superiore può avvenire per scollamento duodenopancreatico e della flessura colica destra. In questo caso i punti circostanti di repere sono i seguenti: la vena cava inferiore, la vena renale destra, l'angolo colico abbassato, il pancreas.
Tratto con modifiche da: Encyclopédie Médico-Chirurgicale (Paris) 43-105 - 40-492.
7.3.2 SEZIONE INTESTINALE E GIUDIZIO SULLA VITALITA' DELLE ANSE
Dopo la rivascolarizzazione, occorre esaminare la vitalità dell'intestino. E' innegabile l'importanza del giudizio «ispettivo» del chirurgo, basato su tre parametri fondamentali:
- colore delle anse;
- pesenza di peristalsi;
- palpazione del polso vasale.
Talora si assiste alla ripresa della peristalsi e del polso, il colore appare normale, e ciò depone a favore del risparmio dell'ansa in esame.
Altre volte, la presenza di necrosi e la mancanza di attività peristaltica non lasciano dubbi riguardo la resezione.
Non sempre, tuttavia, il quadro appare così nettamente definito, e permangono incertezze sul comportamento operatorio che neppure l'esperienza del chirurgo è in grado di dirimere. Di fronte a simili dubbi, l'asportazione di tratti che potrebbero essere vitali rischierebbe di condurre alla cosiddetta «sindrome dell'intestino corto». Al contrario, lasciare in situ anse che potrebbero divenire necrotiche, rischierebbe di condurre il paziente ad un epilogo infausto.
Per tali motivi, sono state messe a punto numerose tecniche di valutazione della vitalità intestinale, tra le quali spiccano l'uso intraoperatorio del doppler ad onda continua e l'infusione di fluoresceina al 5%.
L'esame alla fluoresceina consiste nell'infusione di tale sostanza per via endovenosa, alle dosi di 10-30 mg/kg. La successiva illuminazione del campo operatorio con lampada di Wood a luce ultravioletta, permetterà di visualizzare i tessuti vitali, in grado di captare la fluoresceina. Il lungo tempo di smaltimento e la diffusibilità in tutti i tessuti, costituiscono i limiti principali della fluoresceina, la quale, non potendo essere rapidamente rimossa dal campo operatorio, non rende possibile la ripetizione dell'esame durante un intervento.
In realtà, nessuno di questi mezzi è in grado di fornire certezze, e spesso l'unica
alternativa è offerta dal «second look» a distanza di 12-24 ore.
Uno studio retrospettivo effettuato su 73 pazienti operati per ischemia mesenterica acuta, ha comparato tre tecniche di valutazione:
- palpazione del polso;
- doppler;
- fluoresceina.
il confronto dei dati ottenuti durante la prima seduta operatoria con quelli forniti dal «second look» ha dato i risultati espressi dalla seguente tabella.
Tabella 7.2
Metodo sensibilità specificità valore predittivo accuratezza
valutazione del polso 56% 40% 63% 50%
doppler 0% 0% 0% 0%
fluoresceina 60% 50% 60% 56%
L'ossimetria rappresenta un promettente metodo di giudizio sulla vitalità delle anse. Tale esame permette di valutare il flusso ematico della mucosa in modo indiretto, correlandolo alla saturazione o alla tensione parziale tissutale di ossigeno.
Esistono due tipi di strumenti.
Ossimetri di superficie. Derivano dall'elettrodo di Clark e, misurando la tensione superficiale di ossigeno, forniscono indicazioni sul flusso locale. Hanno lo svantaggio di richiedere più tempo, rispetto agli ossimetri a pulsazione, per una lettura più precisa e sono poco diffusi nella pratica clinica e nei presidi operatori.
Ossimetri a pulsazione. Il principio su cui si basano è spettrofotometrico, e correlano il flusso alla misurazione della saturazione tissutale di ossigeno. A differenza dei precedenti, sono particolarmente diffusi nelle sale operatorie.
7.3.3 IL «SECOND LOOK»
In tutti i casi in cui permangano dubbi sulla vitalità di tratti non resecati, è buona norma effettuare un secondo intervento esplorativo a distanza di 12-24 ore.
Classicamente viene preferito l'intervento a cielo aperto, durante il quale è possibile non solo l'impiego delle tecniche di valutazione citate in precedenza, ma anche l'eventuale resezione di anse necrotiche.
Alcuni Autori, tuttavia, optano per un approccio meno aggressivo, offerto dalla laparoscopia. E' indubbio che tale procedura presenta grandi vantaggi, quali la minore invasività ed il migliore decorso post-operatorio, ma permette soltanto un'ispezione superficiale delle anse, con il rischio di valutazioni errate. Inoltre, in presenza di tratti necrotici, occorrerebbe comunque effettuare una laparotomia. In caso di necrosi limitata a brevi tratti, è stato proposto di procedere con una resezione laparoscopica , ed è doveroso sottolineare che sono state elaborate numerose tecniche al riguardo. Queste, tuttavia, richiedendo una notevole competenza chirurgica e rischiando di allungare i tempi dell'intervento, non hanno ancora avuto particolare successo.
Altri Autori propongono, dopo il primo intervento, il posizionamento di un telo in materiale plastico all'interno della cavità addominale sopra l'omento, evitando di suturare i tessuti soprastanti, i quali andranno accuratamente protetti coprendo l'intero addome con teli in materiale plastico-adesivo. Anche questa tecnica, simile alla «cerniera laparotomica» utilizzata soprattutto nel trattamento della pancreatite necrotico-emorragica, non viene largamente impiegata nell'infarto intestinale.
Capitolo 8
STRATEGIE TERAPEUTICHE NELL' ISCHEMIA E NELL' INFARTO VENOSO
Non appena viene formulata la diagnosi, occorre infondere eparina ed antibiotici ad ampio spettro. Questo è l'unico tipo di ischemia mesenterica che deve essere trattata con terapia anticoagulante per via endovenosa anche durante la seduta operatoria.
L'infusione di eparina non va interrotta neppure nel periodo post-operatorio: nonostante aumenti il rischio di complicanze emorragiche, si riduce l'evenienza di una nuova trombizzazione. La somministrazione prevede un bolo iniziale di 5000 U, seguita da infusione di 1000 U/ora.
Anche per l'infarto venoso valgono le considerazioni fatte in precedenza, sia riguardo il giudizio della vitalità delle anse mediante fluoresceina, sia riguardo la resezione e l'eventuale «second look».
Per quanto riguarda la rivascolarizzazione, alcuni Autori riportano interventi di trombectomia della vena mesenterica superiore coronati da successo. In realtà tale procedura è difficilmente attuabile, dal momento che nella maggior parte dei casi è presente trombosi venosa diffusa o particolarmente estesa.
Anche l'attuazione di una terapia trombolitica appare controverso e rischioso, visto l'elevato rischio emorragico. La mortalità a distanza di 30 giorni rimane ancora elevata.
La tabella seguente correla la mortalità alle strategie terapeutiche adottate da diversi Autori nel trattamento di 164 pazienti.
Tabella 8.1
Trattamento e mortalità di 164 pazienti con ischemia mesenterica acuta venosa
Autore n° pazienti resezione solo laparotomia non operati eparina mortalità
Sack 9 9 0 0 6 2 (22%)
Wilson 16 10 3 3 6 8 (50%)
Clavien 12 12 0 0 12 5 (42%)
Boley 22 22 0 0 22 7 (32%)
Harward 16 5 0 11 7 3 (19%)
Levy 21 19 2 2 17 8 (38%)
Grieshop 15 5 0 10 9 2 (13%)
Rhee 53 30 4 19 33 14 (27%)
Capitolo 9
IL DANNO DA RIPERFUSIONE
Come è stato detto in precedenza, l'ischemia innesca una catena di eventi che evolvono verso la morte cellulare e determinano l'accumulo di metaboliti tossici.
Indubbiamente, la riperfusione di un tessuto ischemico permette la rimozione di tali sostanze ma conduce anche ad una serie di reazioni che, paradossalmente, danneggiano il tessuto stesso.
Parks e Granger hanno dimostrato come il danno osservato dopo 3 ore di ischemia (con flusso ridotto al 20% rispetto al normale) e 1 ora di riperfusione sia maggiore di quello osservato dopo 4 ore di ischemia.
9.1 IL RUOLO DEI RADICALI DELL'OSSIGENO
L'ossigeno molecolare può dare origine a tre composti ossidanti:
- l'anione superossido (O2
- il perossido d'idrogeno (H2O2
- il radicale ossidrilico (OH-).
Tali radicali sono responsabili del danno a carico delle biomolecole tissutali, inclusi gli acidi nucleici, i lipidi di membrana, i recettori e gli enzimi. Il radicale ossidrilico, ad esempio, può agire come potente agente ossidante degli acidi grassi polinsaturi, alterando la fluidità delle membrane e provocando la lisi cellulare.
La xantina ossidasi, enzima chiave nel metabolismo degli acidi nucleici, è implicata in reazioni dalle quali originano anione superossido e perossido di idrogeno.
Tabella 9.1
Le reazioni della Xantino Ossidasi (XO)
ipoxantina + 2O2 + H2O2 ------(XO)------> xantina + O2- + H2O2
xantina + 2O2 + H2O ------(XO)------> acido urico + O2- + H2O2
Durante l'ischemia si verifica un incremento della xantino ossidasi, dovuto alla conversione della xantino deidrogenasi in tale forma ossidante. Questo meccanismo è in gran parte dovuto alla proteolisi ischemica.
9.2 IL RUOLO DEI POLIMORFONUCLEATI
Un'altra potenziale fonte di radicali dell'ossigeno nei tessuti riperfusi è costituita dai leucociti polimorfonucleati neutrofili, la cui migrazione dal circolo aumenta durante la riperfusione.
Questi producono la NADPH ossidasi che riduce l'ossigeno molecolare in anione superossido. Producono, inoltre, l'enzima «mieloperossidasi» (MPO), il quale catalizza la formazione di acido ipocloroso dal perossido d'idrogeno e dallo ione cloro.
Tabella 9.2
Sintesi dell'acido ipocloroso
H2O2 + Cl + H ------(MPO)------> HOCL + H2O
L'acido ipocloroso è un potente agente ossidante, con una reattività circa 100 volte superiore a quella del perossido d'idrogeno.
Reagisce con amine primarie creando composti responsabili di danno citotossico.
Capitolo 10
IL PROBLEMA DELL'INFARTO INTESTINALE DOPO INTERVENTI DI CARDIOCHIRURGIA
L'infarto intestinale come complicanza di interventi cardiochirurgici è una evenienza rara, ma caratterizzata da un alto indice di mortalità.
La letteratura riporta una incidenza inferiore all'1% ed una mortalità oscillante tra il 67% e il 100%.
Uno studio retrospettivo ha riportato un'incidenza dello 0.06% ed una mortalità del 91%. L'infarto intestinale è risultato essere di natura «funzionale» nel 45% dei pazienti (dovuto fondamentalmente al deficit della pompa cardiaca) e di natura embolica nel restante 55%.
Gli emboli possono originare, più frequentemente, da formazioni trombotiche su valvole artificiali ma anche a seguito di aritmie post-cardiochirurgiche.
La possibilità di sopravvivenza è legata esclusivamente alla diagnosi precoce e all'immediato intervento chirurgico, ma il quadro è spesso difficilmente rilevabile e rischia di passare inosservato, specialmente quando il paziente è ancora ricoverato in terapia intensiva.
L'infarto intestinale deve essere sospettato in tutti i pazienti che presentano addome acuto dopo recente intervento cardiochirurgico e si rende necessaria, in tali casi, una laparotomia esplorativa anche in assenza di indagini strumentali preoperatorie (in realtà è comunque buona norma l'esecuzione di una TC addominale).
Capitolo 11
CASISTICA
La casistica consta di 146 casi, osservati ed operati presso la Cattedra di Chirurgia d'Urgenza dell'Università degli Studi di Genova e presso il Pronto Soccorso Chirurgico dell'Ospedale S. Martino, dal 1981 al 1998.
La casistica raccolta offre alla considerazione l'età dei soggetti operati e la prevalenza del sesso femminile (63M/83F).
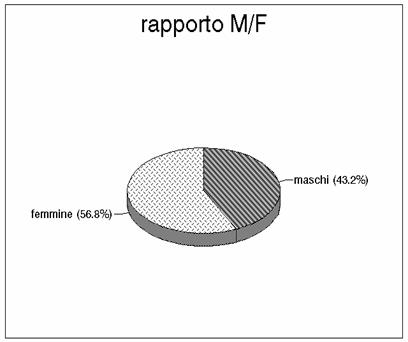
Grafico 1 - Rapporto tra maschi e femmine nella casistica raccolta presso la Cattedra di Chirurgia d'Urgenza. Le femmine prevalgono nettamente.
I casi sono stati trattati con l'intervento chirurgico o con la terapia angioradiologica; per quanto riguarda i pazienti trattati chirurgicamente e la mortalità è stata del 75% nei pazienti con embolia, mentre è stata maggiore, pari al 90%, nei casi con trombosi. Gli infarti venosi sono stati gravati da una mortalità pari a circa il 50%, mentre gli infarti da interessamento funzionale
hanno avuto una mortalità del 95%. I grafici dall'1 all'11 commentano la
nostra casistica.
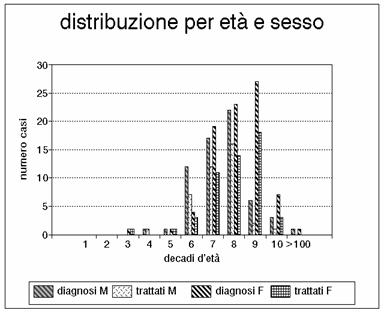
Grafico 2 -
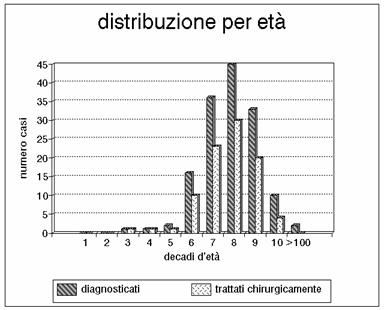
Distribuzione per fasce d'età dei casi giunti all'osservazione e possibilità di
trattamento chirurgico. Nella casistica riportata l'ottava decade di vita è
stata colpita in modo prevalente; per comprendere questo slittamento (nelle
casistiche internazionali la settima decade è la più colpita) bisogna
considerare che la popolazione ligure si è avviata verso un invecchiamento
progressivo.
Grafico 3 - Distribuzione per fasce d'età e sesso dei casi giunti all'osservazione e possibilità di trattamento chirurgico.
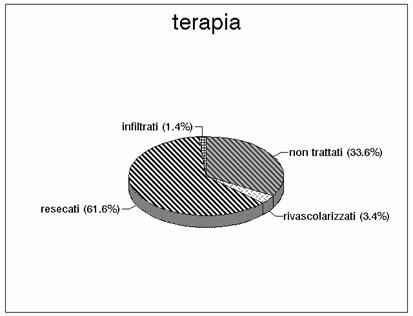
Grafico 4 - Il trattamento chirurgico non è sempre possibile, specie in età avanzata; a dispetto degli sforzi fatti per intervenire in una fase precoce, sono sempre molto frequenti i casi in cui le necrosi sono così estese da impedire qualunque trattamento.
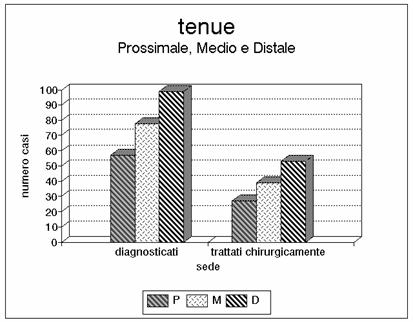
Grafico 5 - In questo istogramma è riportato il numero di lesioni ischemiche che hanno interessato isolatamente i tratti di tenue prossimale, medio e distale. Nella nostra casistica appare una prevalenza delle lesioni che interessano i segmenti distali.
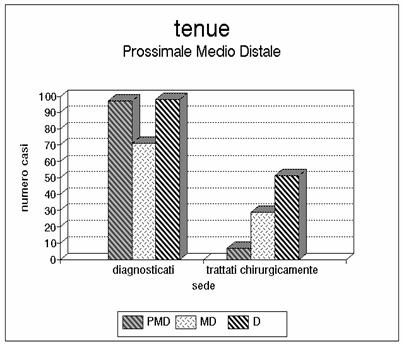
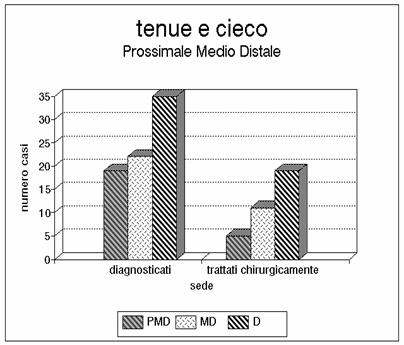
Grafico 6 -
Diagnosi e trattamento delle lesioni del tenue. In alcuni casi la necrosi
comprendeva tutto l'intestino tenue e in questi pazienti non è stato possibile
nessun trattamento chirurgico.
Grafico 7 - In alcuni casi la necrosi comprendeva anche il cieco. In alcuni casi si trattava di ischemie per lesioni della porzione distale della AMS, mentre in altri casi, ma più raramente, era coinvolto anche tutto il tenue.
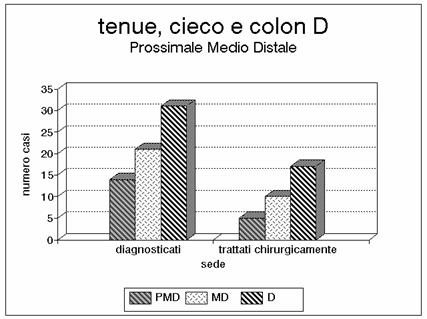
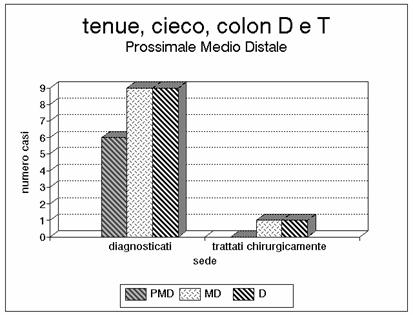
Grafico 8 -
Valgono le stesse considerazioni del grafico precedente In alcuni casi la
necrosi comprendeva oltre al tenue e al cieco anche una porzione di colon
ascendente per coinvolgimento dell'arteria colica destra.
Grafico 9 - La progressione dell'ischemia al colon trasverso indica una lesione che coinvolge anche l'arteria colica media e di conseguenza quasi tutto il tenue. Si tratta per lo più di casi assai gravi, non trattabili chirurgicamente che in percentuale irrisoria e con una mortalità proibitiva.
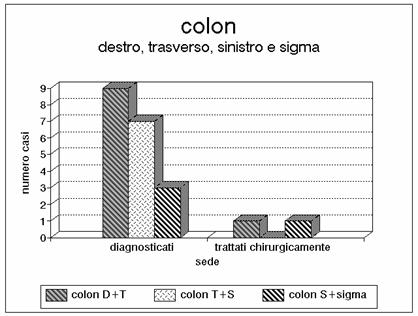
Grafico 10 - La nostra casistica comprende anche qualche rara lesione solitaria del colon destro, sinistro e del sigma per lesioni che interessano isolatamente l'arteria mesenterica inferiore.
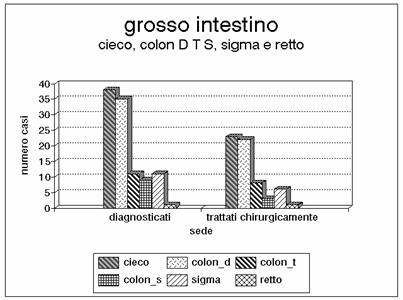
Grafico 11 - Anche il retto può essere sede di lesioni ischemiche. Bisogna considerare che si tratta di un organo che riceve una doppia vascolarizzazione dall'arteria mesenterica inferiore e dell'ipogastrica e pertanto le lesioni sono piuttosto rare.
Il grafico 2 commenta la distribuzione per fasce d'età e l'1 e il 3 la distribuzione per sesso (maggiore quello femminile) ed età. I grafici 5 e 6 evidenziano le lesioni del tenue nel terzo iniziale, medio e distale, mentre nel grafico 7 sono riportate le sedi coliche (cieco, colon destro, colon trasverso, colon sinistro, sigma e retto). Nell'istogramma 8 vengono considerate le lesioni del tenue, come nel grafico 5, ma sono aggiunte le lesioni del cieco, le lesioni del colon destro e nel grafico 9 anche quelle del colon trasverso. Nel grafico 10 viene presentata l'associazione delle lesioni del colon (colon destro, trasverso, sinistro e sigma). Nella porzione di sinistra di tutti gli istogrammi è indicato il numero dei casi osservati, mentre nella porzione di destra è indicato il numero dei casi sottoposti a intervento chirurgico. Tutti i grafici sono ottenuti calcolando i valori assoluti. Il grafico 4 dimostra l'esiguità dei casi trattati con rivascolarizzazione.
CONCLUSIONI
In base a quanto è stato esposto fino ad ora, l'infarto intestinale è gravato da due problemi rilevanti. Il primo è rappresentato dalla precocità della diagnosi, il secondo dal giudizio intraoperatorio sulla vitalità o sulla resecabilità delle anse.
Entrambi i fattori condizionano notevolmente la prognosi quod vitam. La diagnosi e l'intervento precoci (durante la fase dell'ischemia acuta) aumentano le probabilità di successo e di sopravvivenza. In presenza, invece, di lesioni irreversibili, la prognosi è peggiore.
Il giudizio sulla vitalità delle anse risulta importante non solo per la prognosi quod vitam, ma anche per quella quod valetudinem. Lasciare in situ un tratto che potrebbe divenire necrotico, rischierebbe di far precipitare nuovamente il quadro clinico anche fino all'exitus. D'altro canto, resecare un tratto che potrebbe ritornare ad essere funzionale rischierebbe di provocare una sindrome dell'intestino corto, con gravi conseguenze per il paziente. E' per questo motivo che ci viene incontro il «second look».
La prognosi dipende non solo dalla precocità della diagnosi e dell'intervento, ma anche dal tipo di ischemia-infarto, dalla percentuale di intestino interessata e resecata, dall'età del paziente e dalle sue condizioni generali.
In genere, le ischemie acute da ostruzione venosa hanno una prognosi più favorevole di quelle da ostruzione arteriosa. La prognosi è spesso peggiore anche nelle forme «funzionali», a causa della concomitante presenza di altre affezioni (ad esempio cardiopatie). Le forme emboliche hanno gravità intermedia, mentre la mortalità più alta si riscontra nelle forme trombotiche arteriose (80-90%)
BIBLIOGRAFIA
1. Redaelli CA et al.
Intraoperative assessment of intestinal viability by laser Doppler flowmetry for surgery of ruptured abdominal aortic aneurysms.
World J Surg. 1998 Mar;22(3):283-9
2. Ali Shirkhoda et al.
Contrast-enhanced MR Angiography of the Mesenteric Circulation: A Pictorial Essay.
Radiographics 1998 Jul-Aug 18(4):851-65
3. Jacobs MJ,et al.
Retrograde aortic and selective organ perfusion during thoracoabdominal aortic aneurysm repair.
Eur J Vasc Endovasc Surg. 1997 Nov;14(5):360-6
4. Danse EM et al.
Early diagnosis of acute intestinal ischaemia: contribution of colour Doppler sonography.
Acta Chir Belg. 1997 Aug;97(4):173-6.
5. Bjorck M et al.
Risk factors for intestinal ischaemia after aortoiliac surgery: a combined cohort and case-control study of 2824 operations.
Eur J Vasc Endovasc Surg. 1997 Jun;13(6):531-9
6. Moaward J et al.
Current results of surgical theraphy for chronic mesenteric ischemia.
Arch Surg. 1997 Jun;132(6):613-8; discussion 618-9.
7. Bryant DS et al.
Nonocclusive intestinal ischemia: improved outcome with early diagnosis and therapy.
Am Surg. 1997 April;63(4):334-7.
8. JordanD. Rosenblum et al.
The mesenteric circulation.
Surg Clin North Am. 1997 Apr;77(2):289-306.
9. McKinsey JF et al.
Acute mesenteric ischemia.
Surg Clin North Am. 1997 Apr;77(2):307-318.
10. Bassiouny HS.
Nonocclusive mesenteric ischemia.
Surg Clin North Am. 1997 Apr;77(2):319-26
11. Rhee RY et al.
Mesenteric venous thrombosis.
Surg Clin North Am. 1997 Apr;77(2):327-38.
12. Nicoloff AD.et al.
Duplex ultrasonography in evaluation of splancnic artery stenosis.
Surg Clin North Am. 1997 Apr;77(2):339-55.
13. Hackwort CA. et al.
Percutaneous transluminal mesenteric angioplasty.
Surg Clin North Am. 1997 Apr;77(2):371-80.
14. Shanley CJ. et al.
Bypass grafting for chronic mesenteric ischemia.
Surg Clin North Am. 1997 Apr;77(2):381-95.
15. Eldrup-Jorgensen J. et al.
Abdominal vascular catastrophes.
Surg Clin North Am. 1997 Dec;77(6): 13051321.
16. Bronner JF et al.
Acute ischemia and arterial mesenteric infarction in patiens aged over 75. Aprops of a comparative series of 38 cases.
J Chir Paris. 1997 Aug; 134(3):109-13.
17. Bickel A et al.
A technique for second-look laparoscopy in the obese patient.
Laparoendosc Surg. 1996 Apr;6(2):113-5.
18. Voltorini F et al.
Acute mesenteric ischemia. Analysis of 47 cases.
Minerva Chir. 1996 May;51(5):285-92.
19. Taourel PG et al
Acute mesenteric ischemia: diagnosis with contrast-enhanced CT.
Radiology. 1996 Jun;199(3):632-6
20. Regan F et al.
Minimally invasive management of acute superior mesenteric artery occlusion: combined urokinase and laparoscopic therapy.
Am J Gastroenterol.1996May;91(5):1019-21
21. Howard TJ et al.
Nonocclusive mesenteric ischemia remains a diagnostic dilemma.
Am J Surg.1996 Apr;171(4):405-8
22. Johnston KW et al.
Mesenteric arterial bypass grafts: early and late results and suggested surgical approach for chronic and acute mesenteric ischemia.
Surgery. 1995 Jul;118(1):1-7
23. Murray MJ et al.
Serum D(-)-Lactate levels as an aid to diagnosing acute intestinal ischemia.
Am J Surg. 1994 Jun; 167(6):575-8.
24. Klempnauer J et al.
Acute mesenteric ischemia following cardiac surgery.
J Cardiovasc Surg. 1997;38:639-43.
25. Nathan N et al.
Thrombolyse intra-artérielle d'une ischémie aigue mésentérique
Ann Fr Anesth Reanim, 1995;14:33-36.
26. Kimura m et al.
Beneficial effects of Verapamil on intestinal ischemia and reperfusion injury: pretreatment versus postischemic treatment.
Eur Surg Res 1998;30:191-197.
27. Niederhauser U et al.
Mesenteric ischemia after a cardiac operation: conservative treatment with local vasodilatation.
Ann Thorac Surg 1996 Jun;61(6):1817-9.
28. Buth J et al.
The diagnosis and treatment of acute aortic occlusions.
J Mal Vasc. 1996;21(3):133-5.
29. Kam DM et al.
Fluorescein-assisted laparoscopy in the identification of arterial mesenteric ischemia.
Surg Endosc. 1993 Mar-Apr;7(2):75-8
30. Winter III TC et al.
CT angiography of the visceral vessels.
Semin Ultrasound CT MR. 1996 Aug;17(4):339-51.
31. Li KC.
MR angiography of abdominal ischemia.
Sem Ultrasound CT MR. 1996 Aug;17(4):352-9.
32. Kanda T et al.
Intestinal fatty acid-binding protein is a useful diagnostic marker for mesenteric infarction in humans.
Gastroenterology.1996 Feb;110(2):339-43.
33. Shercks et al.
Covering the open abdomen: a better technique.
Am Surg. 1998 Sept;64(9):854-7.
34. Rossi G et al.
New CT sign of intestinal infarction: isolated pneumoretroperitoneum or associated with pneumoperitoneum or late findings of intestinal infarction.
Rad Med (TO).1998 May;95:474-80.
35. Heino A. et al.
Systemic and regional PCO2 gradients as markers of intestinal ischaemia.
Intensive Care Med.1998 Jun;24(6):599-604.
36. Catalano O.
CT in the diagnostic approach to acute mesenteric ischemia.
Rad Med(TO). 1995 Apr;89(4):440-6.
37. Frola C et al.
Gas embolism of the portal venous system. CT findings in 2 cases.
Rad Med(TO). 1993 Dec;86(6):917-9.
38. Frola C et al.
Case report: bowel infarction with splenic air embolism: CT findings.
Br J Radiol. 1994 Dec;67:1272-4.
39. Klempnauer J et al.
Long term results after surgery for acute mesenteric ischemia.
Surgery. 1997 Mar;121(3):239-43.
40. Slutzki S et al.
The laparoscopic second look for ischemic bowel disease.
Surg Endosc. 1996 Jul;10(7):729-31.
41. Halkin A et al.
Management of acute mesenteric ischemia.
N Engl J Med. 1996 Aug;335(8):594-6.
42. Newman TS et al.
The changing face of mesenteric infarction.
Am Surg.1998 Jul;64(7):611-6.
43. Ballard JS et al.
A critical analysis of adjuvant techniques used to assess bowel viability in acute nesenteric ischemia.
Am Surg.1993 May;59(5):309-11.
44. Hermreck AS et al.
Role of supraceliac aortic bypass in visceral artery reconstruction.
Am J Surg. 1991 Dec;162(6):611-4.
45. Kornblith PL et al.
Anatomy of the splanchnic circulation.
Surg Clin North Am.1992 Feb;72(1):1-30.
46. Kurland B et al.
Diagnostic tests for intestinal ischemia.
Surg Clin North Am.1992 Feb;72(1):85-106.
47. Wolf EL et al.
Radiology in intestinal ischemia.Plain film,contrast and other imaging studies.
Surg Clin North Am.1992 Feb;72(1):107-
24.
48. Zimmerman B et al.
Reperfusion injury.
Surg Clin North Am. 1992 Feb; 72(1): 65-83.
49. Connor R et al.
Pneumatosis intestinalis: role of CT in diagnosis and management.
J Comput Assist Tomogr 1984; 8: 269-275.
50. Kaleya RN et al.
Aggressive approach to acute mesenteric ischemia.
Surg Clin North Am. 1992 Feb; 72(1): 157-182.
51.Alpern MB et al.
Ischemic or infarcted bowel: CT findings.
Radiology. 1988; 166: 149-172.
52. Sardo P et al.
Ruolo diagnostico e terapeutico dell'angiografia nell'insufficienza vascolare acuta dell'arteria mesenterica superiore.
Radiol Med. 1988; 75: 319-325.
53.BaKal CW et al.
Radiology in intestinal ischemia: angiographic diagnosis and management.
Surg Clin North Am. 1992 Feb; 72(1): 125-141.
54. Denys A et al.
Doppler sonography of the inferior mesenteric artery: a preliminary study.
J Ultrasound Med. 1995; 14: 435-9.
55. Danse EM et al.
Acute intestinal ischemia due to occlusion of the superior mesenteric artery: detection with Doppler sonography.
J Ultrasound Med. 1996; 15: 323-6.
56.Bocchini T et al.
Mesenteric ischemia due to an occluded superior mesenteric artery treated by percutaneous transluminal angioplasty.
J Clin Gastroenterol. 1995; 20: 86.
57. Krupski WC et al.
Unusual causes of mesenteric ischemia.
Surg Clin North Am. 1997; 77: 471.
58. Bailey RW et al.
Protection of the small intestine from nonocclusive mesenteric ischemia.
Am J Surg. 1987; 153: 108-16.
59. Boley sj et al.
Mesenteric venous thrombosis.
Surg Clin North Am. 1992; 72: 183.
60.Bowersox JC et al.
Duplex ultrasonography in the diagnosis of celiac and superior mesenteric artery occlusive disease.
J Vasc Surg. 1991; 14: 780-788.
61.Koborozos B et al.
Serum phosphate levels in acute bowel ischemia.
Am Surg. 1985; 10: 242-44.
62. Wilcox MG et al.
Current theoriesof the pathogenesis and treatment of non-occlusive mesenteric ischemia.
Dig Dis Sci. 1995; 40: 709-716.
63. Renius JF et al.
Ischemic disease of the the bowel.
Gastroenterol Clin North Am. 1990; 19:319-343.
64. Sarcina A.
Sindromi ischemiche intestinali.
R. Dionigi: Chirurgia. 1997; 786-91.
65. Fuentes FT et al.
Successful intraarterial fragmentation and urokinase therapy in superior mesenteric artery embolism.
Surgery 1995; 117: 712-4.
66. Bergan JJ et al.
Diagnosis of acute intestinal ischemia.
Semin Vas Surg. 1990; 3: 143-8.
67. Whitehill TA et al.
Acute intestinal ischemia caused by arterial occlusions: optimal management to improve survival.
Semin Vas Surg. 1190; 3: 149-56.
68. Beebe HG et al.
Supraceliac aortomesenteric bypass for intestinal ischemia.
J Vasc Surg. 1987; 5: 749-54.
69. Kaleya RN et al.
Acute mesenteric ischemia: an aggressive diagnostic and therapeutic approach.
Can J Surg. 1992; 6: 613-23.
70. Berci G et al.
Emergency laparoscopy.
Am J Surg. 1991; 161(3): 332-336.
71. Bulkey GB et al.
Intraoperative determination of small intestinal viability following ischemic injury.
Ann Surg. 1981; 193(5): 628-637.
72. Rivers SP et al.
Acute nonocclusive intestinal ischemia.
Sem Vasc Surg 1990; 3: 172-175.
73. Mc Sweeney STR et al.
Second look laparoscopy in the management of acute mesenteric ischemia.
Br J Surg. 1994; 81: 90.
74. Hunter GC et al.
Mesenteric ischemia.
Med Clin North Am. 1988; 72: 1091-115.
75. Coraggio et al.
Infarto mesenterico.
Trattato di medicina d'urgenza e Pronto Soccorso. 1994; 219-221.
76. Smerud MJ et al.
Diagnosis of bowel infarction: a comparison of plain films and CT scans in 23 cases.
AJR. 1990; 154: 99-103.
77. Meissner MH et al.
Colon infarction after ruptured abdominal aortic aneurysm.
Arch Surg. 1992; 127: 979.
78. Bandik DF et al.
Colon ischemia accompanyng ruptured abdominal aortic aneurysm.
J Surg Res. 1981; 30: 297.
79. Albes JM et al.
Intestinal ischemia associated with cardio-pulmonary bypass surgery: a life threatening complication.
J Cardiovasc Surg. 1991; 32: 257-33.
80. Brewster DC et al.
Intestinal ischemia complicating abdominal aortic surgery.
Surgery. 1191; 109: 447-454.
81. Klein et al.
Diagnostic imaging of mesenteric infarction.
Radiology 1995; 197: 79-82.
82. Ehrmantraut W et al.
Laparoscopy-assisted small bowell resection.
Am Surg. 1997Nov;63(11):996-1001.
83. Rogers M et al.
Mesenteric vascular problems.
Ann Surg. 1982; 92: 646.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025