|
|
| |
STECHIOMETRIA E FONDAMENTI DELLA TEORIA ATOMICA
1.1 LE ORIGINI DELLA TEORIA ATOMICA E LE LEGGI DELLA COMBINAZIONE CHIMICA.
Ogni spiegazione dei fenomeni chimici si basa sulla "teoria atomica della materia". E' questa una teoria notevole per il dettaglio e l'accuratezza con cui descrive una parte apparentemente incomprensibile del mondo fisico: essa costituisce la più importante raccolta di idee nel mondo della scienza.
Ai filosofi dell'antica Grecia dobbiamo la prima intuizione che le innumerevoli sostanze che ci circondano sono costituite da un numero limitato di sostanze elementari. La teoria dei quattro elementi acqua, aria, fuoco e terra, proposta da Empedocle nel V secolo a.C., dominò la scienza chimica per quasi duemila anni e ne sopravvive il ricordo nel linguaggio ordinario, quando, dovendo descrivere un cataclisma naturale, si parla di <<furia degli elementi>>. Ad un altro filosofo greco, DEMOCRITO, dello stesso periodo, dobbiamo la prima formulazione della "teoria atomica", cioè che la materia non può essere divisa all'infinito, ma esistono delle particelle indivisibili ed immutabili alle quali viene dato il nome di atomi. L'atomo dei greci fu proposto per risolvere un conflitto di logica: da una parte esisteva 545e43f l'osservazione che gli oggetti naturali sono in uno stato continuo di trasformazione; dall'altra esisteva un fede incrollabile sulla permanenza delle cose reali. I greci sentirono che questo punto morto filosofico poteva essere superato se si fossero accettati atomi invisibili come costituenti permanenti dell'universo; le trasformazioni osservabili si sarebbero potute interpretare in termini del moto di tali atomi. Questa teoria fu solo il frutto di una speculazione filosofica senza basi sperimentali.
Le basi logiche che portarono a credere all'esistenza degli atomi furono fornite da DALTON, GAY-LUSSAC e AVOGADRO, con lavori pubblicati nei primi anni del 1800. Il loro merito fu l'interesse a provare un'idea effettuando un esperimento quantitativo; il loro successo fu la dimostrazione che vari dati sperimentali possono essere riassunti da un insieme limitato di generalizzazioni sul comportamento della materia.
Teoria atomica di DALTON
L'idea dell'atomo espressa dai filosofi greci portò a pochi frutti scientifici sino all'inizio del XIX secolo, quando John DALTON, uno scienziato inglese, la usò per spiegare le leggi delle combinazioni chimiche. DALTON descrisse alcune proprietà; la lista delle quali costituisce quella che ora è nota come Teoria atomica di DALTON:
La materia è costituita da particelle definite dette atomi.
Gli atomi sono indivisibili. Nelle reazioni chimiche essi si trasformano; se da soli rimangono inalterati.
Tutti gli atomi di un certo elemento sono identici, sia per la massa sia per le altre proprietà.
Gli atomi di elementi diversi hanno massa e altre proprietà diverse.
Quando gli atomi di elementi diversi si combinano per formare i composti, si formano nuove e più complesse particelle; gli atomi che le costituiscono sono sempre presenti in un rapporto numerico definito.
Il contributo di DALTON non fu solo di proporre una concezione di grande originalità, ma di formulare chiaramente un complesso di ipotesi sulla natura degli atomi; un complesso che metteva in rilievo il peso come la proprietà atomica più importante. Poiché le leggi delle combinazioni chimiche costituirono la prima dimostrazione sperimentale convincente della correttezza delle idee di DALTON, esse rappresentano la base sperimentale della teoria atomica.
Si esaminino ora ciascuna di queste leggi, sia riguardo al ruolo che esse hanno avuto nello sviluppo della teoria atomica, sia riguardo al grado cui sono ancora valide a tutt'oggi.
La legge della conservazione della massa
"Nelle reazioni chimiche non si osservano apprezzabili variazioni (perdita o acquisto) di massa".
La legge della conservazione della massa indica che se dei reagenti chimici sono posti in un recipiente chiuso, che non permette la fuoriuscita di materia, dopo la reazione la massa del recipiente e del suo contenuto sarà identica a quella di prima. Mentre oggi ciò appare abbastanza ovvio, in passato quest'idea aveva creato qualche perplessità. Nei primi studi di questo tipo, sia i reagenti sia i prodotti spesso erano dei gas, e i gas, entrano o escono facilmente dai recipienti aperti. Fino a quando gli scienziati non furono sicuri di tener conto di tutti i reagenti e di tutti i prodotti, cioè di averli raccolti quantitativamente e pesati, la legge della conservazione della massa non ebbe una chiara evidenza.
La legge delle proporzioni definite
"In un dato composto chimico, gli elementi costitutivi si combinano sempre nello stesso rapporto di massa, indipendentemente dall'origine e dal modo di preparazione del composto".
La legge delle proporzioni definite era stata stabilita sperimentalmente prima che DALTON pubblicasse la sua teoria atomica nel 1807 ed il fatto che questa teoria fosse coerente con esperienze già note, costituì evidentemente un argomento a suo favore e ne accelerò l'adozione.
Tale legge costituisce, in molti casi, soltanto un'approssimazione grossolana del comportamento osservato. In primo luogo, la composizione ponderale di ogni composto dipende dai pesi atomici dei suoi elementi costitutivi. Per gli elementi con più di un isotopo, il peso atomico è un numero medio, il cui valore dipende dalla composizione isotopica, che può variare considerevolmente a seconda della fonte dell'elemento. Perciò il peso atomico di un elemento e la composizione ponderale dei suoi composti sono necessariamente soggetti a variazioni, e, di conseguenza, la legge delle proporzioni definite non risulta strettamente verificata. Vi è comunque, un'altra sorgente di più serie trasgressioni della legge delle proporzioni definite. Mentre è vero che i composti formati da molecole singole semplici mostrano una composizione atomica e ponderale definita, è anche un fatto provato sperimentalmente che vi è una variazione evidente nel numero relativo di atomi nei solidi ionici. Le sostanze la cui composizione atomica è variabile sono dette "composti non stechiometrici"; i casi più cospicui si trovano tra i solfuri e gli ossidi dei metalli di transizione.
In effetti si consideri un composto formato da molecole semplici, distinte, come l'ossido di azoto, NO. E' chiaro che affinché la composizione atomica dell'ossido di azoto si discosti dal rapporto 1/1, è necessario modificare in qualche modo la composizione atomica di ciascuna molecola dell'ossido d'azoto. Ma la più lieve variazione effettuabile in una molecola di ossido d'azoto è di aggiungerle o un atomo di azoto o un atomo di ossigeno. Ne risulta la formazione di N2O o di NO2, composti entrambi le cui proprietà chimiche sono distinte da quelle dell'ossido di azoto Si può quindi concludere col dire che non è possibile alcun cambiamento nella composizione atomica dell'ossido d'azoto senza creare nuove specie chimiche. Le composizioni atomiche ponderali dell'ossido l'azoto sono perciò costanti e questo ed altri composti molecolari obbediscono alle legge delle proporzioni definite.
I composti solidi, che non contengono molecole discrete, presentano una situazione completamente diversa. E' possibile preparare cristalli di ossido di titanio, TiO, con un rapporto atomico di 1/1; tuttavia se vengono variate le condizioni di preparazione, è possibile ottenere cristalli la cui composizione può variare da Ti0,75O a TiO0,69: l'ossido di titanio non obbedisce pertanto alla legge della composizione definita.
E' bene osservare che alcuni dei composti impiegati dai chimici nei primi anni del diciannovesimo secolo per "provare" la legge delle proporzioni definite, erano in effetti non stechiometrici. Le variazioni di composizione cadevano d'altra parte nei limiti d'incertezza sperimentale piuttosto ampi delle analisi chimiche di quel tempo. Così questa legge, tanto importante per lo sviluppo della teoria atomica e che oggi costituisce la base per qualsiasi calcolo stechiometrico, rappresenta soltanto un'approssimazione, provata in partenza da dati inadeguati a dimostrare le sue manchevolezze. Si tratta di una situazione comune alla scienza fisica: le leggi vengono derivate da esperienze ed hanno una validità determinata dalla precisione dell'esperimento e dal numero di casi indagati. A mano a mano che esperienze più accurate vengono effettuate in condizioni più varie, le leggi possono avere bisogno di essere perfezionate o debbono venire scartate a favore di una concezione più generale. E' stato utile, perciò, conservare l'idea delle proporzioni definite, riconoscendone tuttavia i limiti.
La legge delle proporzioni multiple
"Quando due elementi formano più composti, le diverse masse di uno che si combinano con la medesima massa dell'altro sono in un rapporto di numeri interi piccoli".
I composti dell'azoto con l'ossigeno costituiscono un classico esempio. Difatti i pesi di azoto che si combinano con 16 grammi di ossigeno in N2O, NO e NO2 sono rispettivamente 28, 14 e 7 g che stanno nel rapporto di 4 : 2 : 1.
La legge delle proporzioni multiple era un'espressione ed un sostegno delle idee di DALTON sulla struttura atomica della materia.
La legge delle proporzioni equivalenti
"Si considerino due sostanze A e B, elementi o composti, capaci di reagire tra loro e con una terza sostanza C. Uno stesso peso di C reagirà con pesi diversi di A e B; il rapporto dei pesi di A e di B è un certo numero, generalmente non intero, che si indicherà con R. Se A reagisce direttamente con B, la legge delle proporzioni equivalenti dice che il rapporto r del peso reagente di A e quello di B è uguale a R, oppure è un multiplo semplice o un frazione di R, cioè: r=nR, dove n è un numero intero oppure un rapporto di numeri interi".
Chiarifichiamo con un esempio. L'azoto (A) e l'ossigeno (B) reagiscono con l'idrogeno (C), per formare rispettivamente ammoniaca (NH3) e acqua (H2O). Un grammo di idrogeno reagisce con 4.66 g di azoto per formare ammoniaca e con 8,0 g di ossigeno per formare acqua. R è perciò 4,6/8,00 = 0,583. Ora, l'azoto e l'ossigeno possono formare tra loro cinque composti; consideriamo la reazione:
N2 + O2 2NO,
in cui r, cioè il rapporto del peso reagente dell'azoto a quello dell'ossigeno, è 28/32=0,875. Secondo la legge delle proporzioni equivalenti,
n = 0.875/0.583 = 3/2.
Per altri composti dell'azoto e dell'ossigeno, n ha valori differenti, ma ognuno di essi è il rapporto di numeri interi.
E' facile constatare che il rapporto R è semplicemente il rapporto di date particelle di A rispetto a particelle di B, moltiplicato per il rapporto dei pesi di queste particelle. La reazione diretta di A con B, preleva particelle di A e di B in un rapporto di numeri interi, che, una volta moltiplicato per il rapporto dei pesi delle particelle A e B, dà il rapporto r. Poiché sia R che r sono collegati dallo stesso fattore a rapporti interi, questi devono essere in relazione tra loro per mezzo di un moltiplicatore (n) che è il rapporto di numeri interi.
DETERMINAZIONE DEI PESI ATOMICI E DELLE FORMULE MOLECOLARI.
Data l'esistenza di atomi di peso caratteristico, e data la loro tendenza a combinarsi nel rapporto di numeri interi, si consideri il problema di determinare sia i pesi atomici che le formule molecolari. E' evidente che se uno di questi fosse noto, l'altro potrebbe essere facilmente determinabile. Se, ad esempio, fosse noto che nell'ossido rameico vi è esattamente un atomo di ossigeno per ogni atomo di rame, il fatto sperimentale che in CuO vi sono 63,5 g di rame per ogni 16 g di ossigeno, significherebbe che i pesi medi relativi di un atomo di rame e di un atomo di ossigeno stanno nel rapporto di 63,5 a 16. In altre parole, il peso atomico del rame sarebbe di 63,5 in una scala che prenda il peso atomico dell'ossigeno uguale a 16. E' così semplice vedere come i pesi atomici possano essere determinati, se le formule sono note; naturalmente il processo è facilmente invertibile; se sono noti i pesi atomici, è facile determinare le formule. Il problema che i chimici dei primi anni del diciannovesimo secolo si sono trovati ad affrontare, era quello di determinare contemporaneamente i pesi atomici e le formule, poiché entrambe non erano note.
L'opera di GAY-LUSSAC, pubblicata nel 1808, fornì ciò che divenne la base definitiva per determinare le formule molecolari. Un'indagine sulle reazioni gassose mostrò che "i volumi secondo i quali i gas si combinano, misurati in condizioni di temperatura e di pressione uguali, stanno approssimativamente nel rapporto di numeri interi piccoli". Ad esempio: 1 m3 di azoto combinandosi con 1 m3 di ossigeno produce 2 m3 di ossido d'azoto.
Fu, poi, AVOGADRO, nel 1811, che seppe trarre le più brillanti deduzioni da queste esperienze. Egli capì che il volume di un gas doveva essere in relazione molto semplice col numero di particelle contenute. Il risultato principale del suo lavoro fu l'enunciazione della famosa ipotesi che: "volumi uguali di gas chimicamente differenti contengono lo stesso numero di particelle purché a pari condizioni di temperatura e pressione". Per spiegare come da due volumi di gas reagente si ottengono due volumi di composto egli fu portato a pensare che le molecole dei gas fossero biatomiche. Pertanto, con l'ipotesi che gli elementi gassosi avrebbero potuto essere formati da molecole poliatomiche, AVOGADRO fece notare che i rapporti volumetrici che accompagnano la formazione dell'ossido d'azoto possono essere spiegate dicendo che:
azoto + ossigeno ossido d'azoto;
1 volume + 1 volume 2 volumi;
n molecole + n molecole 2n molecole;
N2 + O2 2NO;
N4+ O4 2N2O2;
Le righe 1 e 2 rappresentano fatti sperimentali. La riga 3 combina l'ipotesi <<volumi uguali - numeri uguali>> con quella che gas elementari possono essere poliatomici ed evita la necessità di scindere gli atomi offrendo l'alternativa di scindere le molecole poliatomiche. Le righe 4 e 5 contengono due proposte di formule molecolari coerenti con i dati sui volumi di combinazione. Si osserva, però, che, come indica la riga 5, le formule di questi elementi poliatomici sono rimaste non definite, per cui si resta ancora senza uno schema per determinare in maniera sicura pesi atomici e formule molecolari.
In effetti, tra il 1811 ed il 1858, il problema di determinare la scala dei pesi atomici venne sempre più dibattuto. Furono proposte soluzioni che dovettero poi venire abbandonate quando esse non erano in grado di spiegare i fatti sperimentali sempre più numerosi che si venivano scoprendo. La soluzione definitiva fu fornita nel 1858 da Stanislao CANNIZZARO e richiedeva solo una lieve estensione del ragionamento di AVOGRADO.
Analisi di CANNIZZARO
Il punto di partenza del metodo di CANNIZZARO per la determinazione dei pesi atomici è il concetto che una molecola debba contenere un numero intero di atomi di ogni suo elemento costitutivo. Da tale concetto deriva facilmente che in una grammo-molecola (massa in grammi di una sostanza molecolare pari al suo peso molecolare) di un composto debba esservi almeno un grammo-atomo (massa in grammi di un elemento pari al suo peso atomico) di un dato elemento oppure un multiplo intero di esso. Pertanto, se si analizza una serie di composti di tale elemento e si paragonano i pesi dell'elemento contenuti in una grammo-molecola dei vari composti, è ovvio che tutti questi pesi siano multipli interi di qualche numero che molto probabilmente non è altro che il grammo-atomo di tale elemento.
Ora il problema di base per l'utilizzo del metodo di CANNIZZARO è quello della determinazione dei pesi molecolari dei composti. A tal fine si ricorre al principio di AVOGADRO. Difatti, poiché in eguali condizioni di pressione e temperatura, volumi uguali di gas contengono un numero eguale di molecole, i pesi di questi volumi devono stare nello stesso rapporto dei pesi delle loro molecole o dei loro pesi molecolari. In tal modo, disponendo di una tale serie di pesi molecolari relativi, CANNIZZARO stabilì che il peso molecolare dell'idrogeno debba essere 2.
Allo scopo di illustrare il procedimento di CANNIZZARO per la determinazione dei pesi atomici, illustriamo a grandi linee la determinazione del peso atomico dell'ossigeno.
In primo luogo si determinano i pesi molecolari di alcuni composti gassosi dell'ossigeno. Per far ciò si misurano le loro densità rispetto all'idrogeno ad eguali valori di temperatura e pressione e da queste si ricavano i loro pesi molecolari. Ad esempio, da misure effettuate, si ottiene che la densità dell'ossido nitrico è quasi esattamente quindici volte quella dell'idrogeno, per cui, in una scala in cui l'idrogeno è posto uguale a 2, il peso molecolare dell'ossido nitrico è 30.
Il secondo passo consiste nella determinazione del peso di ossigeno contenuto in una grammo-molecola di ciascun composto. Ebbene da analisi chimica si ricava la composizione del composto in percento o in frazione ponderale. La frazione ponderale di ossigeno moltiplicata per il peso molecolare fornisce la quantità desiderata. Ad esempio, quando un grammo di ossido nitrico viene decomposto nei suoi elementi, si ottengono 0.533 g di ossigeno, per cui in 30 g di ossido nitrico vi sono 30 * 0.533 = 16 g di ossigeno.
|
Composto |
Peso molecolare relativo a H2=2 |
Peso di ossigeno in una grammo-molecola |
|
Acqua |
|
|
|
Ossido nitrico |
|
|
|
Ossido nitroso |
|
|
|
Biossido d'azoto |
|
|
|
Anidride solforosa |
|
|
|
Anidride carbonica |
|
|
|
Ossigeno |
|
|
|
Ozono |
|
|
Il terzo ed ultimo stadio consiste nell'esame di questi dati alla ricerca di numeri interi. Il peso più piccolo di ossigeno in una grammo-molecola di un composto è di 16 g e tutti gli altri sono multipli interi di esso, per cui sembra di poter affermare che il peso atomico dell'ossigeno è 16. In effetti tutti i risultati della tabella sono multipli di 8, per cui si potrebbe anche concludere che 8 è il peso atomico dell'ossigeno; tuttavia il fatto che i multipli dispari di 8 non compaiono nella tabella, ci induce a ritenere pari a 16 il peso atomico dell'ossigeno.
In maniera analoga tale procedimento può essere utilizzato per la determinazione dei pesi atomici di altri elementi capaci di formare una serie di composti gassosi.
In definitiva CANNIZZARO, mediante un'intelligente combinazione della legge delle proporzioni multiple e del principio di AVOGADRO, risolse il problema della determinazione dei pesi atomici e quindi delle formule molecolari.
Il metodo di CANNIZZARO si limitò inizialmente alla determinazione dei pesi atomici di elementi che formano composti gassosi. Una scala di pesi atomici completa fu possibile ottenerla in seguito utilizzando altre due leggi: la legge di DULONG e PETIT sulle capacità termiche degli atomi e la legge di MENDELEEV sulla periodicità chimica.
Nel 1819 DULONG e PETIT misurarono il calore specifico, ossia il numero di calorie (cal) richiesto per innalzare di 1 grado Celsius la temperatura di 1 grammo di sostanza, di numerosi metalli. Poiché un grammo-atomo di elementi diversi contiene lo stesso numero di atomi, moltiplicando il calore specifico di ogni elemento per il suo grammo-atomo, si ottiene il calore necessario per innalzare di un grado Celsius un numero fisso di atomi di qualsiasi sostanza. Ad ogni modo i due studiosi scoprirono che il prodotto del calore specifico di un elemento per il proprio peso atomico era, per alcune sostanze, un costante pari a 6:
calore specifico (cal/g grado) peso atomico (g/g atomo) 6 (cal/grado g atomo)
DULONG e PETIT ammisero che questa fosse una relazione universale e che, se questa legge non veniva osservata, ciò significava che si era impiegato un peso atomico errato. Essi trovarono inoltre che era possibile correggere i pesi atomici imprecisi moltiplicando per rapporti interi. In tal modo essi trovarono una relazione che ancora oggi si ritiene precisa entro certi limiti; difatti la capacità termica di una mole di atomi allo stato solido è di circa 6 calorie per grado Celsius.
Nel 1869, MENDELEEV pubblicò una tabella in cui ordinava gli elementi secondo i pesi atomici determinati gradualmente con il metodo di CANNIZZARO. La tabella conteneva spazi vuoti che corrispondevano agli elementi non ancora scoperti o a quelli i cui pesi atomici non erano noti o erano stati calcolati male. Questi spazi vuoti ( o la loro assenza) favorivano la determinazione degli altri pesi atomici.
Finora si è affrontato esclusivamente il problema della determinazione di una scala di pesi atomici, tuttavia resta ancora la questione relativa al calcolo dei valori precisi dei pesi atomici. Per poter affrontare tale ultima questione è opportuno prima chiarire le basi dei valori numerici nella scala dei pesi atomici. Ebbene, per un lungo periodo, i fisici hanno considerato la massa dell'isotopo più abbondante dell'ossigeno, O16, come pari a 16, mentre i chimici consideravano il peso atomico medio della miscela naturale degli isotopi dell'ossigeno (O16, O17 ed O18) come esattamente 16. Queste due considerazioni portarono a due diverse scale di peso atomico. Nel 1961, entrambe le scale furono abbandonate e sostituite da una scala unificata basata sul considerare pari a 12 il peso atomico dell'isotopo più abbondante del carbonio, 12C.
Ad ogni modo, esistono tre importanti metodi per il calcolo dei valori precisi dei pesi atomici:
determinazione accurata dei pesi di reazione e combinazione;
determinazione accurata della densità dei gas;
spettrometria di massa.
I primi due sono perfezionamenti dei metodi classici già discussi, mentre il terzo costituisce un approccio completamente diverso.
Il metodo dei pesi di combinazione consiste nell'effettuare qualche reazione che interessi l'elemento di peso atomico sconosciuto ed un altro elemento di peso atomico noto. Poiché gli atomi si combinano in un rapporto di numeri interi piccoli, il rapporto dei pesi di combinazione è esattamente uguale al rapporto dei pesi atomici o è un multiplo intero di esso. Ad esempio, si trova che 1,292 g di argento (Ag) reagiscono con 0,9570 g di bromo (Br) formando il bromuro di argento (AgBr).
Il rapporto dei pesi reagenti
è uguale al rapporto dei pesi atomici, per cui prendendo
NAg=107,87,
si trova che:
NBr=107,87/1,350=79,90
Tale metodo ha fornito la maggior parte dei pesi atomici oggi accettati, ma va tenuto presente che, nel suo utilizzo, è necessario usare molta attenzione affinché i reagenti siano molto puri, le razioni abbiano un decorso quantitativo e risultino composti di composizione definita.
Il metodo delle densità dei gas consiste nella determinazione accurata delle densità dei gas di cui si vuole conoscere il peso atomico (o quello molecolare). Tale metodo si basa essenzialmente sul principio di AVOGADRO <<volumi uguali - numeri uguali>>, per il quale le densità gassose stanno nel rapporto dei pesi molecolari dei gas. In effetti il principio di AVOGADRO si rivela esatto soltanto a pressioni molto basse, mentre per gas a pressione atmosferica non risulta strettamente valido a causa delle forze intermolecolari diverse per gas differenti.
Vediamo come sia possibile tener conto dell'esistenza delle forze intermolecolari. In effetti l'esperienza e la teoria cinetica dei gas ci dicono che alla pressione limite zero, cioè quando le molecole sono notevolmente lontane e le forze tra di loro sono trascurabili, la densità d dei gas deve essere esattamente proporzionale alla pressione P:
d aP (assenza di forze intermolecolari)
dove la costante di proporzionalità a può essere intesa come la densità che un gas avrebbe alla pressione di 1 atm. (P=1) se tra le sue molecole non agissero forze.
Quando i gas si trovano ad una pressione finita e le forze intermolecolari sono rilevanti, deve esistere un termine di correzione; la soluzione più semplice è la seguente:
d aP+bP2 < > d/P=a bP
Per trovare a basta riportare in un diagramma il rapporto misurato tra la densità e la pressione come funzione della pressione e di trovare l'intersezione della linea retta risultante. In tal modo è possibile ricavare le densità ideali dei gas, che possono essere utilizzate per calcolare i pesi molecolari. Ad esempio, la densità ideale del gas neon (Ne) è 0,9004 g/litro, mentre quella dell'ossigeno (O) è 1,428 g/litro, entrambe ad 1 atm. e 273,1 °K. Poiché uguali volumi di gas contengono numeri uguali di molecole, il rapporto della densità dei gas deve essere uguale al rapporto dei pesi molecolari. Si trova che:
![]()
NNe=0,9004/1,428*31,999=20,18
Il metodo della spettrografia di massa consente di fornire i valori più precisi dei pesi atomici ed è realizzato utilizzando un apposito strumento detto spettrografo di massa, che, in realtà, è principalmente utilizzato per la misura della massa atomica.
Lo spettrografo di massa consta essenzialmente di tre parti principali:
una sorgente di ioni gassosi;
una zona disperdente evacuata;
un rivelatore.
La sorgente ionica è, tipicamente, una piccola camera in cui atomi o molecole gassose vengono bombardati da un fascio di elettroni ad alta energia, ottenuti da un filamento riscaldato. L'urto degli elettroni con le molecole produce ioni positivi, alcuni dei quali sono soltanto frammenti della molecola originale.
Alcuni di tali ioni positivi vengono accelerati da un campo elettrico (di tensione V) ed attraversano rapidamente un tubo ad alto vuoto in cui sono sottoposti all'azione di un campo magnetico. Il tubo è realizzato a vuoto molto spinto di modo che gli ioni possano muoversi senza eccessivi intralci.
L'azione del campo magnetico è tale che gli ioni seguano traiettorie circolari i cui raggi sono dati da:
![]() B
= valore del campo magnetico
B
= valore del campo magnetico
V = caduta di potenziale che fornisce l'accelerazione degli ioni
e/m = rapporto carica/massa di ciascun ione
Gli ioni che hanno lo stesso rapporto carica/massa percorrono la stessa traiettoria. Il percorso di massimo raggio è quello degli ioni il cui rapporto carica/massa è minimo.
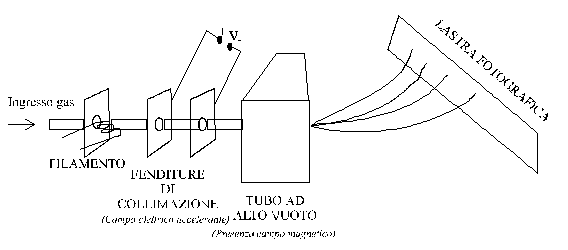
Il rivelatore, che può essere una lastra fotografica, intercetta le traiettorie degli ioni e registra la posizione e l'intensità di ciascun fascio ionico. Per ogni immagine registrata sulla lastra è possibile trovare il raggio di curvatura della corrispondente traiettoria ionica e può essere calcolato il rapporto carica/massa dello ione in questione. Poiché la carica elettrica è la stessa, si riesce così a calcolare la massa di ciascun ione e quindi il suo peso atomico.
In effetti è possibile effettuare i più accurati confronti tra le masse dei frammenti che si trovano l'uno vicino all'altro sulla lastra fotografica, cioè lo spettrografo di massa è capace di risolvere le piccole differenze di massa esistenti tra questi frammenti e, quindi, permette la precisa determinazione delle masse degli isotopi di un dato elemento. A tal proposito va ricordato che il peso atomico degli elementi che hanno più di un isotopo è il numero medio il cui valore dipende dalle quantità relative di ciascun isotopo. Pertanto si rende necessaria la determinazione accurata delle quantità relative degli isotopi di un elemento prima di poter calcolarne il peso atomico. Ciò lo si ottiene sempre con lo spettrografo di massa, solo che anziché registrare gli ioni fotograficamente, il rivelatore effettua una misura elettrica dell'intensità di ogni raggio ionico.
1.3 IL CONCETTO DI MOLE.
Ad ogni sistema materiale risulta utile associare una quantità che sia proporzionale al numero di oggetti elementari che lo costituiscono; oggetti elementari la cui identità conviene definire volta per volta a seconda dell'utilità.
Prima di fare ciò, diamo alcune definizioni elementari:
La massa atomica relativa (o peso atomico relativo) è definita come rapporto tra la massa assoluta dell'atomo (o quella mediata fra i diversi isotopi) e la dodicesima parte della massa dell'atomo 12C.
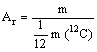
La massa molecolare relativa (o peso molecolare relativo) è definita come rapporto tra la massa assoluta della molecola (o quella mediata fra i diversi isotopi che la costituiscono) e la dodicesima parte della massa dell'atomo 12C.
Talvolta, però, la massa molecolare è una quantità indefinibile, perché indefinibile è la molecola, ossia è una sostanza nella quale non vi sono molecole discrete. In tal caso è sempre possibile assegnare una massa formula o peso formula (e quindi una massa formula relativa o peso formula relativo), che rappresenta la somma delle masse degli elementi presenti nella formula del composto.
Il modo migliore per imparare a calcolare i pesi formula è di eseguire qualche esempio. Qui introdurremo una procedura operativa che in seguito sarà sempre impiegata quella di arrotondare i pesi atomici a tre cifre significative prima di eseguire i calcoli, tranne quando sono richieste più cifre significative.
Calcoliamo il peso formula dell'aspirina, C9H8O4:
C9H8O4 = 9C + 8H + 4O = (9
La quantità che associamo ad ogni sistema materiale la indicheremo come quantità di sostanza e la sua unità di misura è la mole.
Si definisce mole la quantità di sostanza di un sistema che contiene tante entità elementari quanti atomi sono contenuti in 12 g di carbonio 12 (12C).
La quantità di sostanza chiamata mole corrisponde al suo peso formula espresso in grammi. L'unità SI per la quantità di sostanza è chiamata mole, abbreviato mol. La mole, in un certo senso, è un'unità simile alla dozzina, è usata per indicare un certo numero di cose. Possono essere atomi, molecole, elettroni, o qualsiasi altra cosa che si desideri considerare. La grandezza è stata scelta in modo che considerando una mole di atomi di un certo elemento, la massa di quella mole in grammi ha un valore numerico che corrisponde al peso atomico dell'elemento. Una mole di atomi di sodio, per esempio, ha una massa di 22,98977 g, perché il peso atomico del sodio è 22,98977. Analogamente, una mole di atomi di cloro ha una massa di 35,453 g, dato che il peso atomico del cloro è 35,453. La cosa importante, comunque, è che una mole di atomi di sodio contiene esattamente lo stesso numero di atomi di una mole di atomi di cloro.
In base al fatto che l'idea della mole può essere applicata all'unità formula tanto bene quanto agli atomi, risulta semplificata la determinazione della massa di una mole di unità formula. Tutto quello che serve è il peso formula. In una mole di NaCl vi sono tanto numeri di unità formula di NaCl quanti atomi in una mole di atomi di sodio. Il peso di una mole di NaCl in grammi è quindi numericamente uguale al peso formula di NaCl, che è 58,443.
La massa di una sostanza che risulta uguale a una mole è chiamata massa molare, con unità g/mol (g per mole). Per esempio, il peso formula dell'aspirina è 180, così la sua massa molare è 180 g/mol.
Il numero di unità formula in una mole è così grande che in realtà non è possibile tenerne esattamente conto; infatti una mole di una sostanza pura contiene 6,023 1023 unità formula di quella sostanza. Questo numero è chiamata numero di AVOGADRO e può essere facilmente determinato calcolando il rapporto fra la quantità di 12C considerata (12 g) e la massa di un singolo atomo di 12C:
![]()
In effetti tale costante rappresenta proprio il numero di atomi contenuti in un grammo-atomo di ogni elemento o il numero di molecole contenute in una grammo-molecola di un qualsiasi composto.
Quindi la definizione data mette in rilievo che la mole si riferisce ad un numero fisso di qualsiasi tipo di entità elementari.
Se, inoltre, definiamo l'unità di massa atomica (u.m.a.) come la dodicesima parte della massa dell'atomo di carbonio che possiede 6 neutroni (12C):
![]() ,
,
si vede come il numero di Avogadro sia pari a:
![]()
Ad ogni modo, l'uso del termine mole impone che si specifichi la natura delle entità elementari che si vogliono enumerare. È corretto parlare di una mole di elio, una mole di elettroni o una mole di Na+, intendendo rispettivamente un numero di Avogadro di atomi, elettroni o ioni, tuttavia espressioni come una mole di ossigeno senza altra specificazione risultano equivoche; bisognerà, invece, specificare se si tratta di una mole di atomi di ossigeno (O) o di molecole (O2), cioè bisognerà riferirsi ad una mole di atomi di ossigeno o una mole di molecole di ossigeno rispettivamente.
È pratica comune tra i chimici, comunque, lasciare che il nome dell'elemento stia ad indicare la sua forma più frequente. Così una mole di O2 indica una mole di ossigeno, mentre una mole di O indica una mole di atomi di ossigeno.
Il problema che ora ci poniamo è quello di stabilire quale relazione esiste tra la massa di un sistema e l'ammontare di sostanza (numero di moli). Ovviamente la relazione dipende dalla definizione che si è fatta della identità degli oggetti elementari costitutivi del sistema.
Detto ciò, cominciamo con il determinare la massa di una mole di atomi di un elemento chimico. La massa effettiva di un atomo è data da:
![]()
per cui la massa di una mole di tali atomi è data da:
![]()
cioè la massa atomica relativa espressa in grammi rappresenta la massa di una mole di atomi.
Definita la grandezza:
![]()
si ottiene che:
![]()
Quanto visto applicato agli atomi può essere esteso immediatamente alle molecole o ad aggregati atomici genericamente come unità formula nel modo seguente:
![]() n
= numero di mole
n
= numero di mole
m = peso della sostanza
M = peso atomico/molecolare/formula.
1.4 ELEMENTI, COMPOSTI E MISCELE.
Quando la materia si trasforma, in seguito a reazioni chimiche, le più semplici sostanze che si ottengono si chiamano elementi. Non è possibile trovare materia più resistente, i mezzi chimici sono incapaci di decomporre gli elementi in sostanze più semplici. Gli elementi costituiscono quindi la forma più semplice di materia che è possibile incontrare in laboratorio. Alcuni esempi di elementi sono l'argento, l'oro, il ferro e l'ossigeno. I ricercatori hanno scoperto 105 elementi diversi, alcuni dei quali relativamente rari.
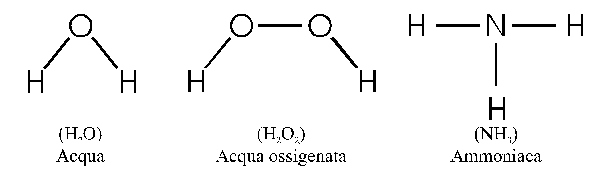
Gli elementi si combinano in varie proporzioni per formare tutte le più complesse sostanze esistenti in natura. L'idrogeno e l'ossigeno si combinano per formare acqua, ferro e ossigeno per formare ruggine. La parola composto è usata per descrivere una sostanza formata da due o più elementi in cui gli elementi sono combinati in un rapporto costante. Per esempio, l'acqua è composta da idrogeno e ossigeno; nell'acqua, qualunque sia la sua provenienza, idrogeno e ossigeno sono sempre in un rapporto di 1 g di idrogeno a 8 g di ossigeno. L'acqua ossigenata (perossido di idrogeno) è un altro composto formato da idrogeno e ossigeno, dove questi due elementi sono combinati in un diverso rapporto costante, 1 g di idrogeno per 16 g di ossigeno.
Gli elementi e i composti sono esempi di sostanze pure. La composizione di una sostanza pura è sempre la stessa, indipendentemente dalla sua origine.
Comunque, le sostanze pure non sono frequenti; di solito si incontrano miscele di composti o di elementi. Contrariamente alle sostanze pure, le miscele hanno composizione variabile; zucchero e acqua sono esempi di composti, ma quando lo zucchero è sciolto nell'acqua, si forma una miscela la cui composizione dipende dalla quantità di zucchero che è stato disciolto nell'acqua.
Le miscele possono essere classificate come:
omogenee;
eterogenee.
Una miscela omogenea ha le stesse proprietà (come densità e composizione) in tutte le sue parti. Esempi sono le miscele ben agitate di acqua e zucchero o acqua e sale. Una soluzione viene definita come una miscela omogenea.
Una miscela eterogenea è composta da due o più parti, o fasi, che differiscono nelle proprietà. Una miscela di benzina e acqua è un esempio di miscela composta da due fasi; la benzina galleggia e l'acqua si separa in basso. Un altro esempio è rappresentato da una miscela formata da acqua e ghiaccio; anche se entrambe le fasi hanno la stessa composizione, la maggior parte delle altre proprietà sono diverse.
1.5 SIMBOLI CHIMICI.
I simboli chimici sono abbreviazioni usate per indicare i nomi degli elementi. A ciascuno degli elementi è stato assegnato un simbolo chimico, che viene usato per scrivere le formule e le equazioni chimiche. Nella maggior parte dei casi i simboli sono formati da una o due lettere; il simbolo del carbonio è C, del bromo e Br e del bario Ba. In alcuni casi i simboli sono derivati dai nomi latini assegnati a questi elementi dagli alchimisti al momento della scoperta.
Riguardo al simbolo, la prima lettera è sempre maiuscola e la seconda minuscola. Per esempio, il simbolo del rame e Cu, e non CU. Questa regola deve essere seguita con attenzione, in modo da evitare confusioni fra simboli diversi, come Co (cobalto) e CO (ossido di carbonio).
1.6 FORMULE CHIMICHE.
Per formula chimica si intende la scrittura sintetica, internazionale, a mezzo di indici e simboli chimici, di una sostanza composta.
Le formule sono quindi le parole del codice o linguaggio dei chimici e pertanto devono essere intese, scritte ed impiegate secondo tale codice. È bene sottolineare che una formula chimica non è qualcosa di astratto, nata per caso dal cervello di uno studioso, ma è un esito sperimentale. Ad essa si arriva infatti per gradi, attraverso operazioni manuali ed elaborazioni matematiche.
Le formule chimiche forniscono molti tipi di informazione. In un certo senso, la formula chimica per un composto rappresenta il modo più breve per scriverne il nome; analogamente, i simboli chimici rappresentano il nome degli elementi. La caratteristica più importante di una formula, comunque, è che essa specifica la composizione di una sostanza chimica complessa.
Il tipo più semplice di formula chimica è dato dalla formula minima, che si limita ad indicare soltanto gli atomi costituenti il composto nel loro rapporto numerico di combinazione.
Ad esempio, l'acqua è un composto chimico costituito da idrogeno ed ossigeno nel rapporto atomico di 2 : 1. La sua formula minima viene quindi costruita scrivendo i simboli dell'idrogeno e dell'ossigeno e ponendo in basso a destra i numeri 2 ed 1 rispettivamente. Dato che, per convenzione, il numero 1 non viene trascritto, la formula minima dell'acqua risulta H2O.
Il procedimento per la determinazione della formula minima di un composto è il seguente:
si prende una certa quantità della sostanza di cui si vuole determinare la formula; attraverso un procedimento di analisi (Analisi Qualitativa) si ricercano e si stabiliscono le specie chimiche semplici in essa presenti, ossia si determinano quali sono gli elementi che combinandosi tra loro hanno dato la sostanza composta;
si prende poi una determinata quantità di sostanza ed attraverso un altro procedimento (Analisi Quantitativa) si determinano le quantità di ogni elemento semplice, accertato essere presente in essa con l'analisi qualitativa;
si determina quindi, con il calcolo, la composizione centesimale dei vari elementi semplici. A questo punto si elaborano matematicamente questi ultimi dati attraverso le seguenti fasi:
a) si dividono i valori delle percentuali dei vari elementi ciascuno per la rispettiva massa atomica relativa dell'elemento (in pratica si convertono le proporzioni di massa in proporzioni di moli);
b) i rapporti ottenuti vengono divisi per il più piccolo di essi;
c) questi ultimi quozienti rappresentano gli indici minimi che si debbono attribuire ai singoli elementi formanti il composto;
d) l'insieme di simboli e di indici così ottenuto rappresenta la formula minima che si attribuisce alla sostanza esaminata.
Ad esempio, si supponga che, in base all'analisi chimica, una certa sostanza risulta avere la seguente composizione centesimale:
![]()
a) Dividendo i valori delle percentuali per le rispettive masse atomiche relative degli elementi S, H, O, si ottengono i seguenti rapporti:
![]()
b) Dividendo i rapporti ottenuti per il più piccolo di essi, si ha:
![]()
c) e d) I quozienti rappresentano gli indici minimi da attribuire ai singoli elementi, per cui la formula minima da attribuire alla sostanza esaminata è:
H2SO4
Nei composti chimici in cui siano presenti molecole o ioni molecolari, al posto della formula minima si usa generalmente la formula molecolare, che può coincidere con la formula minima oppure può esserne un multiplo intero.
Ad esempio idrogeno ed ossigeno possono formare, oltre all'acqua, un altro composto, l'acqua ossigenata, in cui vengono a trovarsi nel rapporto numerico 1:1, per cui la formula minima di questo composto è HO, mentre la formula molecolare risulta H2O2.
Il metodo sperimentale per risalire dalla formula minima alla formula molecolare è quello di determinare il peso molecolare del composto e verificare se esso coincide con quello che può calcolarsi aritmeticamente dalla formula minima, attraverso i pesi atomici degli elementi, o se ne è invece un multiplo.
I due tipi di formula chimiche esaminati sono utili ma assai limitati come informazione concettuale. Difatti tali formule:
indicano sempre:
gli elementi presenti nella sostanza composta (Composizione Qualitativa);
in quale numero gli atomi di questi ultimi sono rispettivamente presenti (Composizione Quantitativa);
non indicano mai:
la disposizione spaziale dei vari atomi, ossia se essi giacciono ad esempio tutti su di uno stesso piano o se sono invece su piani diversi;
il modo in cui si legano, nello spazio, i vari atomi formanti il composto;
non danno un'idea sulla forma delle molecole;
indicano a volte:
la molecola della sostanza composta.
Un tipo di formula più elaborata che si può usare per descrivere molecole e ioni molecolari, è la formula di struttura o formula sterica, con la quale si intende la traduzione in simboli chimici dell'effettiva dislocazione spaziale reciproca assunta dagli atomi formanti la sostanza in questione.
Pertanto essa aggiunge ai dati precedenti l'informazione di come sono legati fra di loro gli atomi che costituiscono il composto. Le formule di struttura si costruiscono scrivendo i simboli degli atomi e collegandoli con dei trattini:
Formule di struttura più significative si ottengono indicando gli atomi non con il loro semplice simbolo letterale, ma con il loro simbolo elettronico:
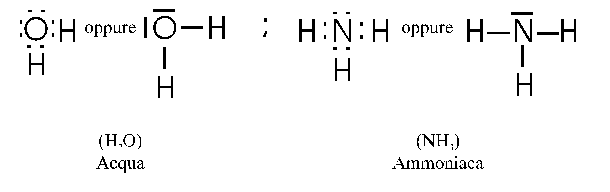
1.7 REAZIONI CHIMICHE.
La chimica può essere definita come lo studio della composizione delle sostanze e del loro comportamento in relazione alla composizione. Uno dei comportamenti più interessanti è che la maggior parte di esse, sottoposte a reazione chimica, formano nuove sostanze.
Una reazione chimica quindi è un processo meccanico secondo cui un sistema meccanico di atomi passa da uno stato in un altro.
L'aspetto affascinante delle reazioni chimiche è che, quando si sviluppano, provocano enormi variazioni delle proprietà dello sostanze. Ciò è determinato dal fatto che varia la composizione individuale dei componenti chimici.
Vi sono diversi modi di classificare le reazioni chimiche, nessuno dei quali è però ineccepibile. Una possibile classificazione di tipo elementare prevede il raggruppare le diverse reazioni chimiche in quattro categorie principali:
reazioni di combinazione o di sintesi
reazioni di decomposizione o di analisi
reazioni di sostituzione
reazioni ioniche
Le reazioni di combinazione o di sintesi sono quelle in cui due o più sostanze si combinano per formare una sostanza più complessa. Esempio di tal tipo di reazione è quello dell'idrogeno e dell'ossigeno che si combinano per formare l'acqua.
Le reazioni di decomposizione o di analisi rappresentano l'opposto delle precedenti: in esse infatti una sostanza complessa si scinde in due o più sostanze più semplici. Anche qui ricordiamo l'esempio dell'acqua che si scinde ovvero si decompone, formando idrogeno ed ossigeno.
Le reazioni di sostituzione sono quelle in cui una sostanza viene sostituita, in un suo composto, da un'altra sostanza. Per esempio, lo zinco sposta il rame da una soluzione di solfato di rame per cui si ha formazione di solfato di zinco e liberazione di rame che si deposita, essendo insolubile.
Nelle reazioni descritte finora si ha sempre una diversa distribuzione degli elettroni condivisi oppure un trasferimento di elettroni da un atomo ad un altro. Nelle reazioni ioniche, invece, non si ha alcun trasferimento di elettroni, ma gli ioni esistenti in soluzione si combinano formando prodotti che per le loro caratteristiche si allontanano dal mezzo in cui ha luogo questo tipo di reazione. Per esempio, se ad una soluzione di cloruro di sodio, in cui cioè sono presenti tanto gli ioni sodio quanto gli ioni cloro, aggiungiamo una soluzione di nitrato di argento che a sua volta contiene ioni nitrato e ioni argento, gli ioni argento reagiranno con gli ioni cloro formando un precipitato bianco di cloruro di argento. Gli ioni sodio e nitrato invece resteranno in soluzione e, facendo evaporare l'acqua, si possono recuperare come nitrato di sodio. Questo tipo di reazione in cui si verifica uno scambio di posto fra il sodio e l'argento viene anche detto reazione di doppio scambio.
Come si vede, queste reazioni hanno luogo solo se uno dei prodotti si forma per sottrazione di ioni dalla soluzione, cioè se il prodotto è un solido insolubile (precipitato) oppure una sostanza gassosa anch'essa insolubile.
Le reazioni chimiche sono sempre accompagnate da manifestazioni energetiche. L'energia si manifesta più comunemente sotto forma di energia termica (calore), ma può anche aversi sotto altra forma, per esempio sotto forma di energia luminosa, sonora, meccanica, elettrica o chimica.
A tal proposito distinguiamo le reazioni chimiche in:
reazioni esotermiche
reazioni endotermiche
Chiamiamo reazioni esotermiche quelle trasformazioni che sono accompagnate da sviluppo di energia (l'energia della reazione è considerata come positiva) e reazioni endotermiche quelle che assorbono energia dall'esterno durante il loro svolgimento (l'energia pertanto è considerata negativa). Quindi nelle reazioni esotermiche l'energia che si manifesta rappresenta la differenza fra il contenuto energetico delle sostanze che reagiscono ed il contenuto energetico delle sostanze prodotte (queste ultime hanno un contenuto energetico minore); viceversa, nelle reazioni endotermiche il contenuto energetico delle sostanze prodotte è maggiore di quello delle sostanze che reagiscono, per cui la differenza deve essere somministrata dall'esterno.
1.8 RELAZIONI STECHIOMETRICHE: L'EQUAZIONE CHIMICA.
Un'equazione chimica dà il quadro <<prima e dopo>> la reazione chimica, ossia descrive quello che succede quando avviene una reazione chimica.
Tale descrizione viene effettuata sia qualitativamente che quantitativamente, in un modo allo stesso tempo accurato e preciso.
Per descrivere una reazione qualitativamente occorrono i simboli che illustrino lo stato o la condizione dei reagenti e dei prodotti come essi si presentano nelle condizioni di reazione.
Due principi qualitativi sono i seguenti:
quando uno degli atomi reagenti è presente in più di una forma, la specie a concentrazione massima viene usata per scrivere la reazione chimica;
non bisogna includere nell'equazione le specie chimiche che non sono usate o prodotte dalla reazione, anche se esse possono essere presenti nel sistema reagente.
L'aspetto quantitativo di una reazione è espresso dai coefficienti stechiometrici (la stechiometria di una reazione è la descrizione delle quantità relative, in moli, dei reagenti e dei prodotti; questa si ricava dai coefficienti dell'equazione bilanciata della reazione) che compaiono nell'equazione chimica. In molti casi questi coefficienti rappresentano soltanto "numeri relativi" di molecole che partecipano ad una reazione chimica. In altri casi le equazioni chimiche vengono usate per descrivere il comportamento di singole molecole.
Per esempio, la reazione fra acido muriatico (acido cloridrico) e lisciva (idrossido di sodio) può essere rappresentata da un'equazione:
![]()
HCl è la formula dell'acido cloridrico, NaOH quella dell'idrossido di sodio. Queste sue sostanze sono chiamata reagenti e vengono scritte a sinistra della freccia. I prodotti di reazione, le sostanze presenti dopo che la reazione è avvenuta, sono scritti a destra della freccia. Di conseguenza, i prodotti della reazione sono cloruro di sodio, NaCl, e acqua. Il significato della freccia è <<reagisce per dare>>. Così, l'equazione riportata dice che l'acido cloridrico e l'idrossido di sodio reagiscono per dare cloruro di sodio e acqua.
Molte reazioni sono più complesse di quella esaminata. Un esempio può essere la combustione del butano, C4H10, il liquido usato negli accendini; l'equazione corrispondente a questa reazione chimica è:
![]()
In questa equazione vi sono dei numeri, chiamati coefficienti, posti prima di ciascuna formula; essi servono per bilanciare l'equazione. Un'equazione risulta bilanciata se è presente lo stesso numero di atomi di ciascun elemento da ambedue le parti della freccia. Il 2 prima di C4H10 significa che reagiscono due molecole di butano; questo comporta un totale di otto atomi di carbonio e venti atomi di idrogeno. A destra sono presenti 8 molecole di CO2, che contengono un totale di 8 atomi di carbonio; analogamente, 10 molecole d'acqua contengono 20 atomi di idrogeno. Alla fine possono essere contati 26 atomi di ossigeno in ciascuna delle due parti dell'equazione.
L'equazione chimica è quindi un esempio di equazione conservativa, poiché essa esprime il fatto che in una reazione il numero di atomi di ogni elemento è costante, ossia che si mantiene immutato. Questo è, naturalmente, il principio usato per bilanciare l'equazione. L'equazione rappresenta inoltre il fatto che le reazioni chimiche non creano né distruggono cariche elettriche libere.
In un'equazione chimica a volte è necessario specificare gli stati fisici dei reagenti e dei prodotti: vale a dire, se essi sono solidi, liquidi o gas. Questo si fa scrivendo le lettere s, l o g fra parentesi dopo la formula chimica del composto.
Per esempio, l'equazione corrispondente alla combustione del carbonio presente nel carbone può essere scritta:
![]()
A volte può essere utile indicare che una sostanza è sciolta in acqua. Ciò si ottiene scrivendo le lettere aq, con il significato di soluzione acquosa.
Per esempio, l'equazione relativa alla reazione fra HCl e NaOH, descritta precedentemente, può essere scritta come:
![]()
1.9 CALCOLI STECHIOMETRICI.
Il procedimento seguito per risolvere quasi tutti i problemi stechiometrici è di scrivere un'equazione basata sulla conservazione degli atomi (o bilancio delle moli) ed applicare ad essa l'espressione che mette in relazione il numero di moli con il peso e con il peso molecolare della sostanza interessata. Soltanto l'esperienza, comunque, potrà permettere di valutare la bontà di questo procedimento e la possibilità di usarlo.
Consideriamo un primo semplice esempio:
"Trovare il peso di anidride carbonica (CO2) che può essere ottenuto dalla combustione di 12,0 g di ossido di carbonio (CO) in eccesso di ossigeno"
L'equazione chimica rappresentativa della reazione è la seguente:
2CO+O2=2CO2
e stabilisce che 2n molecole di ossido di carbonio ed n molecole di ossigeno vengono impiegate per formare 2n molecole di anidride carbonica, dove n è un numero qualsivoglia. Prendendo n=N, l'equazione dice che due moli di ossido di carbonio più una mole di ossigeno possono essere convertite in due moli di anidride carbonica.
Questo ragionamento spiega come tutto ciò che si può dire sui numeri relativi di atomi o di molecole, si può anche dire sui numeri relativi di mole.
Un primo metodo risolutivo è il cosiddetto metodo delle moli, che consiste nell'osservare la conservazione degli atomi di carbonio nella reazione chimica.
Pertanto:
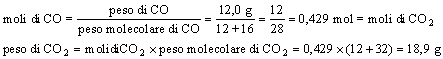
Un secondo metodo risolutivo è il cosiddetto metodo delle proporzioni che consiste nello stabilire una proporzione diretta tra peso e peso delle n molecole di CO e di CO2:
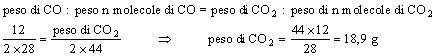
In un raffronto tra i due metodi utilizzati, si preferisce l'applicazione del metodo delle moli per due principali motivi:
utilizza informazioni derivanti direttamente dal principio di conservazione degli atomi;
nel caso di voglia determinare il peso dell'ossigeno consumato nella reazione, non bisogna stabilire nuovamente una proporzione, ma basta scrivere:
![]()
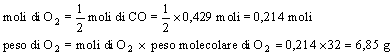
L'utilità dell'uso del concetto di mole risulta più evidente quando si affronta il problema della determinazione delle formule empiriche di un composto. La formula empirica esprime soltanto i numeri relativi di atomi di ogni elemento che si trovano in un composto e può essere dedotta sperimentalmente misurando i pesi degli elementi necessari a sintetizzare una certa quantità del composto o inversamente analizzando un campione di sostanze per trovare il peso dei suoi elementi costitutivi. I risultati di tale determinazione vengono spesso espressi come composizioni percentuali in peso.
Ad esempio si voglia determinare la formula empirica di un certo quantitativo di solfuro di ferro contenente il 46,5% in peso di ferro ed il 53,5% di zolfo. Ricordando che quello che si dice sul numero relativo di moli può anche dirsi sul numero relativo di atomi, basta semplicemente calcolare il numero relativo delle moli di ferro e di zolfo. Supposto di avere 1 g di solfuro di ferro, si ha:

da cui:
![]()
Per contare il numero di molecole, oltre alla pesata, si può ricorrere, nei gas, al cosiddetto volume molare normale. A tal proposito ricordiamo che la legge di AVOGADRO asserisce che "a parità di condizioni di temperatura e di pressione, volumi uguali di gas contengono eguale numero di particelle". Ebbene sperimentalmente si è trovato che alla pressione di 1 atmosfera ed alla temperatura di 273,1 °k (condizioni note come temperatura e pressione normale TPN) una mole di qualunque gas occupa un volume molto prossimo a 22,4 litri. Pertanto, per ogni campione di gas è possibile trovare il numero di moli confrontando il suo volume a TPN con 22,4 litri:
![]()
Ad esempio si consideri la decomposizione termica del clorato di potassio KClO3 descritta dalla seguente equazione:
![]()
supposto di aver ottenuto 637 cm3 di ossigeno a TPN, si vuole determinare il peso originale di KClO3 ed il peso di KCl.
Ebbene:
![]()
inoltre, invocando il principio di conservazione degli atomi di ossigeno:

|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2026