|
|
| |
MOLECOLE BIATOMICHE
Orbitali molecolari:
Gli orbitali rappresentano lo spazio in cui è probabile e possibile trovare elettroni. Per costruire quindi un modello di una molecola bisogna trovare un gruppo di orbitali molecolari e riempirli con gli elettroni a disposizione, ponendone non più di due per orbitale.
Legame nella molecola H2:
Due atomi di idrogeno a grande distanza non si influenzeranno, ma man mano che si avvicinano risentiranno di un effetto reciproco.
L'effetto più importante è l'attrazione che il nucleo di un atomo risente per la nuvola elettronica dell'altro, per cui le nuvole elettroniche dei due atomi sono attratte dai due nuclei. Il sistema costituito da due nuclei e da due elettroni combinati è più stabile perché ha un'energia più bassa, quindi più gli atomi si avvicinano più essi si attraggono e l'energia molecolare diminuisce. Però c'è un limite anche a questo, perché se gli atomi si avvicinano troppo cominciano a predominare le forze repulsive, oltre questo limite quindi la repulsione è maggiore dell'attrazione.
Esiste quindi una distanza di equilibrio in qui le forze attrattive e repulsive si bilanciano, questa distanza viene detta lunghezza di legame.
L'attrazione dei due atomi è dovuta all'attrazione del nucleo sulla densità elettronica dell'altro atomo, per cui si può considerare il legame come la sovrapposizione degli orbitali 252h78c 1s.



![]()
![]()
![]()
![]() +
+
Orbitale di legame
Nella molecola di idrogeno l'orbitale, che è dato dalla somma dei due orbitali, è riempito con due elettroni di spin opposto e si forma un legame covalente singolo, e l'orbitale è detto orbitale di legame.
Vi è un altro modo di combinare un legame, e cioè invece di sommare gli orbitali li sottraiamo.
![]()
![]()
![]()
![]()
![]()
![]()

 Quando sottraiamo le due funzioni d'onda un atomo cambia segno a metà
strada fra i nuclei,
Quando sottraiamo le due funzioni d'onda un atomo cambia segno a metà
strada fra i nuclei,
Orbitale di antilegame
e quindi si ha che la densità elettronica
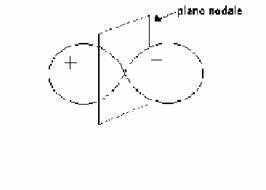 sarà localizzata nella regione esterna ai due nuclei, mentre
al centro fra i due nuclei al piano nodale la probabilità di trovare elettroni
è zero.
sarà localizzata nella regione esterna ai due nuclei, mentre
al centro fra i due nuclei al piano nodale la probabilità di trovare elettroni
è zero.
Questo tipo di orbitale molecolare è detto orbitale di antilegame.
Più i nuclei si avvicinano allo stato di antilegame più sono tirati indietro dalle loro nuvole elettroniche e più l'energia della molecola cresce.
Ricapitolando quindi i due orbitali s possono combinarsi in due modi dando luogo o a orbitali di legame o orbitali di antilegame.
Gli orbitali di legame concentrano la densità elettronica tra i due nuclei, mentre gli orbitali di antilegame nella regione esterna dei due nuclei e al centro al piano nodale una densità zero.
Entrambi questi orbitali sono simmetrici alla rotazione, cioè se si ruota la molecola intorno ad un asse che passa orizzontalmente tra i due nuclei né la nuvola elettronica né il segno della funzione sono alterati, orbitali che posseggono questa simmetria sono detti orbitali sigma ( ), l'orbitale di antilegame è indicato con * e quello di legame con b.
Costruzione delle molecole secondo Paulie:
Lo ione H2+ ha due nuclei e un solo elettrone, secondo Paulie quindi egli tenderà a posizionarsi sull'orbitale a più bassa energia che è l'orbitale b, questo ione è debolmente stabile. Mentre per H2 entrambi gli elettroni si posizioneranno con spin opposto nell'orbitale b e l'energia per strappare un elettrone da questa molecola sarà maggiore rispetto a quella del suo ione molecolare.
Per l'He2+ ha due nuclei e tre elettroni, i primi due elettroni occuperanno l'orbitale b, il terzo sarà costretto nell' che tenderà a tenere i due nuclei separati per cui la molecola ha un contributo netto di legame di un elettrone cioè mezzo legame covalente, l'energia di legame perciò è più debole di H2.
He2 invece è una molecola che non esiste perché dovendo avere quattro elettroni due si posizioneranno nell' b e due nell' con un contributo netto di legame pari a zero.
Per ricapitolare di seguito sono riportati i punti della teoria dell'orbitale molecolare:
Si combinano gli orbitali in modo da ottenere un gruppo di orbitali molecolari, il numero di orbitali molecolari ottenuto sarà uguale al numero di orbitali presi in considerazione.
Si decide l'ordine di energia degli orbitali molecolari.
Si dispongono gli elettroni negli orbitali molecolari iniziando da quello con energia più bassa e ponendone non più di due per orbitale.
Si esaminano gli orbitali di legame e di antilegame pieni per stabilire il contributo netto di legame.
Molecole biatomiche omonucleari:
Le molecole come O2, Cl2, N2 che contengono un solo tipo di atomo sono dette omonucleari, quelle come HCl, CO, eteronucleari.
Per gli orbitali degli elementi del secondo periodo gli orbitali atomici a disposizione sono il 2s e i tre 2p. Gli orbitali 2s danno luogo ad un orbitale di legame e uno di antilegame proprio come gli 1s.
Per gli orbitali 2p invece abbiamo due tipi di orbitali 2p, gli orbitali 2pz che sono paralleli all'asse internucleare z, e gli orbitali 2pz, 2px, che sono invece ortogonali all'asse internucleare. I due orbitali 2pz dei due atomi si possono combinare con lo stesso segno producendo una densità elettronica tra i due nuclei e quindi un orbitale di legame σz b, oppure possono combinarsi con il segno opposto e quindi produrre una deficienza di elettroni tra i due nuclei e quindi un orbitale di antilegame σz entrambi questi due tipi di orbitali sono anch'essi orbitali perché sono simmetrici alla rotazione.
Gli orbitali 2px possono combinarsi uguale segno e formare un orbitale di legame che sembra la versione ingrandita del 2px originario, questo tipo di orbitale ha i massimi di densità elettronica in due lobi tra il piano nodale e i due lobi hanno segno opposto. Gli orbitali 2px posso anche combinarsi con segno opposto e forma un orbitale con due piani nodali e quattro lobi di densità elettronica che vanno verso l'esterno del nucleo, in cui ogni lobo superiore e di segno opposto a quello inferiore dando luogo ad un orbitale di antilegame. Questi due orbitali sono chiamati πxb e πx* e non sono simmetrici rispetto all'asse z perché se si ruota di 180° l'asse la nuvola di densità rimane invariata ma il segno si inverte. Gli orbitali 2py danno luogo agli equivalenti degli orbitali 2px che sono πyb e πy* anch'essi non simmetrici all'asse z.
A partire dagli otto orbitali atomici abbiamo ottenuto otto orbitali molecolari quattro di legame (σsb σzb, πxb, πyb) e quattro di antilegame (σs σz , πx*, πy*).
Gli orbitali molecolari ottenuti dagli orbitali s sono di energia inferiore rispetto a quelli ottenuti dagli orbitali p e in oltre gli orbitali di legame hanno energia inferiore agli orbitali di antilegame. I primi due livelli più stabili sono σsb e σs per gli orbitali p invece i livelli più stabili sono πxb e πyb.
Gli orbitali πxb e πyb hanno la stessa energia per cui vengono detti degeneri, dopo questi orbitali viene l'orbitale σzb e successivamente gli orbitali πx* e πy* e infine l'orbitale σz
Paramagnetismo ed elettroni spaiati:
Una sostanza contenente molecole o ioni con elettroni spaiati risente dell'influenza di un campo magnetico che rende la molecola magnetica.
Molte sostanze dette paramagnetiche allontanate dal campo magnetico perdono il loro magnetismo, la forza di attrazione che esse subiscono dal campo magnetico può essere utile per determinare il numero di elettroni spaiati.
Se una molecola non ha elettroni spaiati essa è diamagnetica ed è leggermente respinta dal campo magnetico.
Molecole biatomiche eteronucleari:
Per poter combinare due orbitali atomici per formare un orbitale di legame e uno di antilegame, i due orbitali atomici devono avere energia simile. Infatti, in una molecola come H2 i due orbitali 1s contribuiscono entrambi la 50% nell'orbitale molecolare.
Ma se invece si combina una molecola del tipo AB dove A ha un orbitale ad alta energia e B un orbitale a bassa energia, vedremo che per l'orbitale di antilegame contribuisce quasi esclusivamente la specie con l'orbitale ad alta energia (A), mentre per l'orbitale di legame contribuisce quasi esclusivamente l'orbitale di bassa energia (B).
Questo significa che non si tratta di un legame covalente, ma solo di un orbitale B con una coppia di elettroni solitaria.
Questo significa che l'interazione tra i due orbitali è trascurabile e la molecola acquista un parziale carattere ionico tipo HF.
Nella molecola HF l'orbitale 1s dell'idrogeno ha un'energia molto diversa dall'orbitale 1s del fluoro per cui questi non interagiscono, anche l'orbitale 2s del fluoro ha energia troppo bassa mentre gli orbitali 2p hanno un'energia adatta per interagire con l'orbitale 1s dell'idrogeno, però gli orbitali 2px e 2py hanno simmetria non adatta per combinarsi con l'orbitale 1s di H, per cui l'unico in grado di combinarsi è il 2px in questo modo si ottengono due orbitali molecolari uno di legame e uno di antilegame, le tre coppie solitarie del fluoro occupano rispettivamente gli orbitali 2s, 2px e 2py.
Il legame b è più vicino come energia al 2p de fluoro e quindi il legame covalente non è perfettamente simmetrico e gli elettroni avranno maggiore probabilità di stare maggiormente dalla parte del fluoro, per cui la molecola HF assume un carattere parzialmente ionico (Hδ+ Fδ-).
In molecole invece come HCl, HBr e HI i legami sono più covalenti perché le molecole hanno un elettronegatività simile.
Momento dipolare:
Una molecola biatomica eteronucleare come HF, possiede un momento elettrico dipolare, generato dalla separazione delle cariche positive da quelle negative.
Se una carica negativa e una positiva di grandezza q sono separate da una distanza r, il momento dipolare (μ) è dato dal prodotto q per r:
μ = qr
Questo ci dimostra che la maggior parte dei legami non è né puramente covalente né puramente ionico.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025