|
|
| |
... per chi ha "fretta"
![]() Che
cosa sono?
Che
cosa sono?
Per soluzione tampone si intende una soluzione acquosa in grado di mantenere pressoché inalterato il proprio pH, in seguito all'aggiunta di moderate quantità di acidi o basi forti, o rispetto alla diluizione della soluzione stessa.
Hanno potere tampone le soluzioni contenenti:
a) un acido debole e il suo sale con una base forte;
b) una base debole e il suo sale con un acido forte.
In sostanza, definendole nell'ottica della teoria di Bronsted e Lowry, le soluzioni tampone sono costituite da una coppia acido-base coniugata debole.
![]() Come
si preparano?
Come
si preparano?
Una soluzione tampone può essere preparata in due modi diversi:
a) Aggiungendo direttamente alla soluzione l'acido (o la base) debole e il suo sale. Ad esempio: acido acetico e acetato di sodio, oppure ammoniaca e cloruro di ammonio.
b) Aggiungendo l'acido (o la base) debole e una base (o un acido) forte. Ad esempio: acido acetico e NaOH, oppure ammoniaca e HCl.
Nel primo caso, le concentrazioni dell'acido e della base coniugata sono immediatamente note, essendo equivalenti alle concentrazioni analitiche dell'acido e del sale.
Nel secondo caso queste dovranno essere ricalcolate attraverso la stechiometria della reazione (a completamento):
HA + OH- → H2O + A-
in cui HA indica l'acido debole, OH- la base forte e A- la base coniugata dell'acido.
Ad esempio,
se
[HA] = C°a - [NaOH] =
[A-] = [NaOH] =
Poiché la [H ] in una soluzione tampone è data da:
![]() (1.1)
(1.1)
la scelta della coppia acido-base adeguata a "tamponare" ad un determinato pH deve essere fatta in funzione del 858h73i la Ka dell'acido.
Si noti che la 1.1 può essere utilizzata
per qualsiasi soluzione tampone, indipendentemente da come è stata ottenuta o
da come la si descriva: in una soluzione tampone si ha infatti sempre una
coppia-acido base coniugata.
In altri termini, anche il pH di una soluzione preparata da ammoniaca e cloruro
di ammonio si può calcolare con l'equazione 1.1. In tal caso, l'acido è lo ione
ammonio e la base coniugata l'ammoniaca;
Esercizi
1. Calcolare
il pH di una soluzione preparata con ammoniaca e cloruro di ammonio 0.01 +
Inizio modulo
Fine modulo
2. Calcolare
il pH di una soluzione preparata aggiungendo 0.02 moli di NaOH a
Inizio modulo
Fine modulo
![]()
![]() Come
funzionano?
Come
funzionano?
L'uso di un esempio concreto, faciliterà sicuramente la
comprensione del funzionamento di una soluzione tampone.
Supponiamo di avere preparato una soluzione contenente acido acetico e ioni
acetato nella stessa concentrazione:
CH3COOH + H2O = H3O+ + CH3COO- (1)
Poiché la concentrazione dell'acido acetico è uguale a quella dell'acetato, la [H ] = Ka dell'acido (vedi 1.1) e pH = pKa (ovvero 4.74).
Se
aggiungiamo un acido forte, ad esempio HCl, ad una concentrazione
CH3COO- + HCl → CH3COOH + Cl- (2)
L'acido
aggiunto è quindi completamente "neutralizzato" dagli ioni acetato,
presenti in largo eccesso rispetto all'HCl, e si forma una quantità di acido
acetico (e di ioni cloruro) pari alla quantità di HCl aggiunto.
Ma di quanto è cambiato il pH? Se avessimo aggiunto la stessa quantità di acido
cloridrico all'acqua pura, avremmo risposto prontamente che il pH sarebbe sceso
da
E nella soluzione acido acetico-acetato?
La risposta non è ovviamente altrettanto immediata: occorre prima ricalcolare
le concentrazioni dell'acido acetico e dell'acetato. In pratica, è come se si
trattasse di una titolazione di una base debole con un acido forte. Abbiamo già
osservato che si forma una quantità stechiometrica dell'acido debole, che diventa
pertanto 0.1 + 0.01 =
A questo punto è possibile utilizzare la 1.1 per calcolare la [H ], che
risulta 2.2 x 10-
Se
aggiungiamo invece una base forte, ad esempio NaOH, ad una
concentrazione di
CH3COOH + NaOH → CH3COO- + Na+ + H2O (3)
Il risultato
è perfettamente "speculare" al caso dell'aggiunta dell'acido forte:
la base aggiunta è totalmente "neutralizzata" dall'acido acetico, la
cui concentrazione si riduce a 0.1 - 0.01 =
![]()
... per chi vuole "soffermarsi"
![]() Il
Potere Tampone
Il
Potere Tampone
Fino a che punto una soluzione tampone può opporsi a variazioni
della propria concentrazione idrogenionica in seguito all'aggiunta di acidi o
basi forti?
E da cosa dipende questa capacità, il suo potere tampone?
Daremo subito una risposta al secondo interrogativo e successivamente cercheremo di sostenere la validità delle due preposizioni che seguono, rispondendo così, più o meno indirettamente, anche al primo quesito.
Il potere tampone di una soluzione dipende:
a) dalla sua concentrazione;
b) dal rapporto tra le concentrazioni della coppia acido-base coniugata.
Quantitativamente, possiamo esprimere il potere tampone di una soluzione in due modi alternativi, sebbene strettamente correlati. Ovvero, come:
1) L'entità della variazione del pH della soluzione in funzione dell'aggiunta di una quantità fissa, arbitraria di un acido o una base forte.
2) Gli equivalenti di acido o base
forte che, aggiunti a
La seconda definizione è più rigorosa, ed è quella che utilizzeremo.
a) Potere tampone e concentrazione
Tenendo
presente il meccanismo attraverso il quale la soluzione tampone agisce, è
intuitivo concludere che maggiore è la concentrazione della coppia acido-base
coniugata, maggiore è la quantità di acido o base forte che può essere aggiunta
senza provocare "importanti" variazioni del pH.
Ad esempio, se a
Se invece aggiungiamo la stessa quantità di HCl a
Il potere tampone è quindi direttamente proporzionale alla concentrazione della
soluzione.
b) Potere tampone e rapporto acido : base coniugata
Il potere tampone di una soluzione è massimo quando la [acido debole] = [base coniugata]. Ovvero, quando il loro rapporto è 1:1.
Valuteremo quantitativamente,
attraverso la definizione data al punto 2, la variazione del potere tampone
della soluzione acido acetico - acetato (0.1 +
Dobbiamo
quindi calcolare quanti equivalenti di acido forte, ad esempio HCl, si devono
aggiungere a
Il pH iniziale è 4.74; quanti equivalenti di HCl occorrono per portarlo a 3.74?
È necessario fare in modo che il rapporto fra la coppia acido-base coniugata
sia tale da soddisfare l'equazione:
![]()
Ovvero, 10-3.74/1.8x10-5
= 10.
Data la stechiometria della reazione (2), dobbiamo risolvere l'equazione:
([acido debole] + [HCl]) / ([base coniugata] - [HCl]) = 10
Posto [HCl] = x, abbiamo che (0.1 + x) / (0.1 - x) = 10, da cui x = 0.082
eq./litro.
0.082 è quindi il potere tampone della nostra soluzione.
Nella
"nuova" situazione, la soluzione ha ancora lo stesso potere tampone?
Una risposta quantitativa a questo interrogativo non è certamente immediata, ma
la risposta qualitativa dovrà essere pronta: "No, il potere tampone è
diminuito."
Vedremo poco più avanti che il potere tampone, oltre ad essere diminuito, è diverso
nei confronti di un acido o di una base, essendo diverso il rapporto di
concentrazioni dell'acido e della base coniugata.
Per il momento limitiamoci a calcolare il "nuovo" potere tampone, nei
confronti di un acido forte.
Nella
"nostra" soluzione, la concentrazione dell'acido acetico è ora
La domanda è quindi: quanti equivalenti di HCl si devono aggiungere a
Ripetiamo esattamente il calcolo fatto in precedenza e troviamo che il rapporto
[acido]/[base] deve essere 100. Posto [HCl] = x, da (0.182 + x) / (0.0182 - x)
= 100, si ricava che x = 0.016 eq./litro: il potere tampone si è ridotto
a circa un quinto di quello iniziale.
Se ripetessimo nuovamente il calcolo, troveremmo che a questo punto il potere tampone si è ulteriormente ridotto ad un decimo del precedente: un cinquantesimo di quello iniziale.
Facciamo adesso un passo indietro e calcoliamo invece il potere tampone della soluzione a pH 3.74, nei confronti di una base forte. Un semplice calcolo, se mai ce ne fosse bisogno, ci dice che per portare il pH a 4.74 sono necessari 0.082 eq./litro di NaOH. Ovvero il potere tampone nei confronti di una base è cinque volte quello nei confronti dell'acido.
c) Limite funzionale di una soluzione tampone
Normalmente,
l'intervallo "efficace" di una soluzione tampone si considera
compreso fra pKa ± 1. Ciò corrisponde ad un rapporto fra [acido debole]
e [base coniugata] compreso fra 0.1 e 10.
Tuttavia, anche entro limiti compresi fra 0.05 e 20, o anche leggermente più
ampi se la soluzione è abbastanza concentrata, il tampone conserva una certa
efficienza. Quindi il limite funzionale può essere considerato compreso fra pKa
± 1.4
Esercizi
1. Calcolare
il potere tampone di una soluzione ammoniaca / cloruro di ammonio 0.4 +
Inizio modulo
Fine modulo
2. Una
soluzione tampone è preparata aggiungendo 0.02 equivalenti di NaOH a
Inizio modulo
Fine modulo
![]()
... per chi vuole "approfondire"
![]() A
cosa servono?
A
cosa servono?
Nella sperimentazione biochimica, l'impiego delle soluzioni
tampone è routinario: non vi è praticamente tecnica che non ne faccia uso.
Molte molecole biologiche sono particolarmente sensibili al pH del mezzo, sia
per quanto riguarda la loro attività, sia la loro stabilità. Velocità di
reazione e equilibrio chimico dipendono spesso dal pH. L'attività degli enzimi
si esplica quasi sempre entro limiti di pH molto ristretti (pH ottimale); il pH
ha inoltre un effetto diretto sulla ionizzazione di molti substrati o può
addirittura compromettere la stabilità stessa dell'enzima.
Tuttavia, qualcuno potrebbe a questo punto contestare la necessità di ricorrere
all'uso di soluzioni tampone, se lo scopo è solo quello di avere soluzioni a un
particolare pH.
Ovviamente il ricorso alle soluzioni tampone è motivato dall'esigenza
primaria di mantenere il valore del pH entro ben determinati limiti. In
modo quindi da cautelarsi contro possibili variazioni del pH causate
dall'aggiunta al sistema in esame di sostanze con proprietà acido-base più o
meno spiccate, oppure dovute all'attività stessa dei componenti del sistema.
Infatti, nel corso di una reazione enzimatica si possono verificare variazioni
della concentrazione idrogenionica della miscela di reazione, come avviene ad
esempio nel caso delle reazioni catalizzate dalle deidrogenasi piridiniche, in
cui il coenzima (NAD) "rilascia" uno ione H per ogni
coppia di idrogeni rimossi dal substrato.
![]() Sistemi
tampone fisiologici
Sistemi
tampone fisiologici
Il pH dei fluidi del'organismo, in particolare del sangue, è regolato attraverso un complesso meccanismo omeostatico. Dal punto di vista chimico, ad esso concorrono principalmente tre sistemi tampone:
1. diidrogenofosfato - idrogenofosfato
2. acido carbonico - idrogenocarbonato
3. proteine - anioni proteinato
Il pH del sangue deve essere mantenuto entro limiti abbastanza rigidi. Il valore normale nel sangue arterioso è 7.41: già a valori inferiori a 7.38 e superori a 7.45, i patologi parlano rispettivamente di acidosi e alcalosi. Se queste condizioni non vengono compensate, si può andare incontro a tutta una serie di manifestazioni patologiche, fino al coma. Valori di pH inferiori a 7 e superiori a 7.8 sono incompatibili con la vita.
1. Il tampone fosfato funziona attraverso il seguente equilibrio:
H2PO4- + H2O = H3O+ + HPO42- (4)
H2CO3 + H2O = H3O+ + HCO3- (5)
La pKa
dell'acido carbonico è 6.1; a pH 7.4 il rapporto delle concentrazioni della
coppia acido-base è quindi circa 0.05 (in un litro di sangue vi sono infatti
1.2-1.4 millieq. di acido carbonico e 24-28 millieq. di idrogenocarbonato). Il
potere tampone di questa coppia è al limite dell'efficienza, tuttavia il
tampone bicarbonato si trova in una posizione del tutto speciale, in quanto i
suoi due componenti sono sotto stretta regolazione da parte di due processi
omeostatici fisiologici: respirazione e funzione renale.
Attraverso il controllo della respirazione polmonare (iperventilazione e
ipoventilazione) può essere controllata la concentrazione della CO2
sciolta nel sangue e quindi, in pratica, la concentrazione dell'acido
carbonico. L'anidride carbonica in soluzione è infatti in equilibrio con
l'acido carbonico secondo la reazione:
CO2 + H2O = H2CO3 (6)
A
Parallelamente, il rene può regolare la concentrazione degli ioni monoidrogenocarbonato reimmessi in circolo, attraverso il bilanciamento dei processi di sintesi di acido carbonico (catalizzata dalla anidrasi carbonica tubolare a spese della CO2 prodotta nel catabolismo ossidativo) e di controllo dell'escrezione urinaria di ioni H o HCO3-:
CO2 + H2O = H2CO3 = H+ + HCO3- (7)
3. Anche il contributo delle proteine plasmatiche, tra cui è fondamentale quello dell'emoglobina, non è indifferente. Grazie ai numerosi gruppi ionizzabili con proprietà acido-base dei loro residui amminoacidici laterali, le proteine svolgono un'importante attività tampone, secondo l'equilibrio:
proteina = H+ + ione proteinato-
![]()
... e per chi ha tempo per "riflettere"
![]() Calcolo
"esatto" del pH
Calcolo
"esatto" del pH
Fin dall'inizio di questo "capitolo" abbiamo
sottolineato che le soluzioni tampone sono soluzioni contenenti una coppia
acido-base coniugata.
Ben presto abbiamo anche osservato che il rapporto [acido debole] : [base
coniugata] deve collocarsi entro determinati limiti, affinché la soluzione
possa svolgere in maniera adeguata la propria funzione tampone.
Tuttavia, per quanto riguarda il calcolo del pH, abbiamo usato invariabilmente
l'equazione 1.1, fuori e dentro "l'intervallo tampone", e avevamo
fatto lo stesso nel corso della titolazione di un acido debole, anche nelle
condizioni "estreme": all'inizio e in prossimità del punto di
equivalenza.
Ora, il problema è che la 1.1 è, ovviamente, una formula approssimata. Dobbiamo quindi chiederci se sia stato sempre "lecito" l'uso che ne abbiamo fatto. È possibile che nelle condizioni estreme si siano fatte, senza rendercene conto, approssimazioni grossolane nel calcolo del pH?
Iniziamo la
nostra discussione, partendo da un caso "limite" per un tampone: la
base coniugata presente in soluzione deriva unicamente dalla dissociazione
dell'acido debole.
La formula approssimata per il calcolo del pH in questo caso è ormai familiare:
![]() (1.2)
(1.2)
Così come le due approssimazioni contenute in essa:
1) [acido] = C°a
2) H proviene unicamente dall'acido
Confrontiamo questa formula con quella, altrettanto familiare, che si usa per le soluzioni tampone:
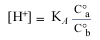 (un altro modo di scrivere la 1.1)
(un altro modo di scrivere la 1.1)
Peraltro, questa equazione mette in evidenza l'approssimazione contenuta in essa: le concentrazioni dell'acido e della base sono quelle analitiche e non quelle all'equilibrio.
Se la base coniugata presente in soluzione proviene unicamente dalla dissociazione dell'acido debole, C°b = [H ] e quindi:
![]() (1.3)
(1.3)
Ovvero, si ottiene la formula approssimata per gli acidi deboli.
C'é quindi da aspettarsi che le due approssimazioni contenute nella 1.2, siano contenute anche nella 1.1. E in effetti lo sono, come abbiamo già sottolineato.
A questo punto, presi dalla disperazione, ci chiediamo: "Qual è allora la formula per il calcolo esatto del pH delle soluzioni tampone?"
Ovviamente esiste una formula esatta anche per le soluzioni tampone. Tuttavia, prima di proporla, occorre valutare se e quando valga la pena utilizzarla.
Nel caso
della dissociazione di un acido debole, la [base coniugata] dipende dalla
concentrazione dell'acido e il suo rapporto con la [acido debole] (ovvero il
grado di dissociazione) aumenta, come sappiamo, con la diluizione della
soluzione.
Nel caso di una soluzione tampone, la base coniugata viene aggiunta come sale
(oppure si forma in quantità stechiometrica in seguito all'aggiunta di una base
forte).
Nell'equilibrio generico:
HA + H2O = H3O+ + A- (8)
l'aumento della [A-] sposta l'equilibrio a sinistra e la [HA] si approssima sempre più alla C°a. Quindi, nel caso di una soluzione tampone, la 1a approssimazione diventa assai meno influente: si ampliano infatti i limiti di validità della formula approssimata.
La 2a approssimazione potrebbe avere invece un rilievo nel caso di tamponi molto diluiti, specialmente qualora la differenza di concentrazione fra acido e base coniugata fosse molto elevata.
È tuttavia
necessario, a questo punto, fare alcune considerazioni di ordine pratico. Nelle
comuni tecniche del laboratorio di biochimica, il pH dei tamponi impiegati è
compreso generalmente in un intervallo di ± 3 unità rispetto alla neutralità,
con concentrazioni comprese fra 0.2 e
In sostanza, il problema del calcolo "esatto" del pH di un tampone si
porrebbe solo raramente, per acidi (o basi) di media forza (pKa < 3 o >
11) e riguardarebbe unicamente la 1a approssimazione.
![]() La
formula "esatta"
La
formula "esatta"
Nonostante si possa fare a meno di conoscerla, qualcuno, incline al "perfezionismo" o magari solo per valutare il grado di approssimazione dei propri calcoli, potrebbe chiedere quale sia infine la panacea che risolve tutti i problemi.
La formula
esatta è ancora un'equazione di terzo grado, molto simile a quella che già
conosciamo. La si può derivare nel modo consueto (vedi il "box" nel
capitolo sugli acidi deboli), attraverso
Fatte le opportune sostituzioni, dopo semplici passaggi algebrici, dal sistema
si arriva alla seguente equazione:
![]() (1.4)
(1.4)
che ha validità generale per qualsiasi soluzione contenente una coppia acido-base coniugata, monoprotica. È proprio in questo contesto, più che per le soluzioni tampone, che essa trova applicazione.
Analogamente a quanto abbiamo fatto nel caso degli acidi deboli, anche questa equazione può essere abbassata di un grado, considerando trascurabile il prodotto Kw Ka:
![]() (1.5)
(1.5)
Si noti che abbiamo anche considerato Kw trascurabile rispetto a Ka C°a.
Per valutare
l'approssimazione implicita nella formula 1.1 si risolva il seguente problema
mediante la 1.5:
Calcolare il pH di una soluzione tampone preparata con un acido debole
Inizio modulo
Fine modulo
![]() Il
Potere tampone 2
Il
Potere tampone 2
Quando abbiamo descritto quantitativamente il potere tampone di
una soluzione, abbiamo dato due definizioni ed abbiamo usato la seconda a scopi
illustrativi.
In realtà, esiste una terza definizione, assai affine alla prima, ma basata
sulla variazione del pH in seguito ad aggiunte di quantità infinitesime
di un acido o una base forte.
Questa definizione, che è da considerarsi la più rigorosa delle tre, ha la
seguente espressione matematica:
![]() (1.6)
(1.6)
V indica il volume in litri; δequiv./V è pertanto la variazione infinitesima della concentrazione della base (o dell'acido) aggiunta.
Il potere tampone così definito rappresenta l'inverso del differenziale della curva di titolazione in ciascun punto dello stato di avanzamento della stessa. Una curva di titolazione riporta infatti il pH in funzione degli equivalenti di base aggiunta. Più piatta è la curva (pendenza -> 0), maggiore è il potere tampone (inverso della pendenza -> ∞). Per chiarire il concetto, lo si potrebbe definire "potere tampone istantaneo".
In base a
questa nuova definizione, potete determinare il potere tampone di una soluzione
calcolando il pH per una coppia di valori dati delle concentrazioni dell'acido
e della base e per una nuova coppia dopo l'aggiunta, ad esempio, di 10-6
equivalenti di base (10-6 è sufficientemente piccolo per poter
essere considerato infinitesimo in rapporto alle concentrazioni dell'acido e
della base). Fate infine il rapporto tra 10-6 e |pH1 - pH2|.
Ovviamente, percorrendo questa via, è necessario fare un calcolo accurato dei
valori dei due pH, utilizzando e "portandosi dietro" diversi
decimali.
Si può tuttavia dimostrare che l'equazione 1.6 può essere trasformata nella
1.7, di più facile impiego, essendo espressa in termini di concentrazioni
dell'acido e della base:
![]() (1.7)
(1.7)
Ca e Cb indicano rispettivamente la concentrazione dell'acido e della base coniugata.
Esercizi
1. Con la
nuova definizione di potere tampone, calcolare il potere tampone di una
soluzione di acido acetico
Inizio modulo
Fine modulo
2. Calcolare
il potere tampone di una soluzione ammoniaca / cloruro di ammonio 0.4 +
Inizio modulo
Fine modulo
![]()
![]() Soluzioni
di acidi e basi forti
Soluzioni
di acidi e basi forti
Ritenete che
le soluzioni di acidi o basi forti abbiano proprietà tampone?
Provate a calcolare il potere tampone di una soluzione di HCl
Confrontatelo con quello dell'acido acetico
Suggerite qualche ragione per cui queste soluzioni non trovano impiego come
soluzioni tampone, se non in casi eccezionali.
![]() Equazione
di Henderson-Hasselbalch
Equazione
di Henderson-Hasselbalch
Avrete forse
notato che, nonostante la lunga carrellata sulle soluzioni tampone, non ho mai
menzionato la nota equazione di H-H.
In effetti ho una certa antipatia per questa formula per il calcolo del pH
delle soluzioni tampone, per diversi motivi.
Prima di tutto impone uno sforzo di memoria e comunque viene mal ricordata
dagli studenti, che spesso confondono il segno fra pK e log, oppure invertono
le concentrazioni delle due specie.
In secondo luogo non apre la mente a certe considerazioni sugli equilibri
acido-base. Spesso ne vengono presentate due versioni, una per il pH e una per
il pOH; inoltre si parla di Ka, Kb, sali, etc.
Infine: è possibile che addirittura in due siano diventati famosi per la banale
trasformazione logaritmica di un'equazione tanto elementare, quanto esemplare,
come la 1.1?
In definitiva, è preferibile dimenticarla!
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025