|
|
| |
Legge di Avogadro:
La legge di Avogadro dice che volumi uguali di qualsiasi gas, nelle stesse condizioni di temperatura e pressione, contengono uno stesso numero di molecole.
Ciò significa che la densità, la massa per unità di volume (g ml-1), deve essere proporzionale al peso molecolare del gas: n = R ∙ V (a T e P costanti)
Pressione di un gas:
La pressione è una delle componenti dell'equazione di stato dei gas, e fu misurata per la prima volta da Torcicolli che misurò la pressione atmosferica, esercitata sulla terra, tramite il barometro. Il barometro è formato da una canna di vetro, chiusa ad un'estremità, alta un metro e una vaschetta di vetro. Riempiendo l'intera canna di Hg e capovolgendola nella vaschetta, anch'essa riempita di Hg, si nota che il mercurio della canna non cade totalmente nella vaschetta ma si ferma a 760 mm. (760 mm = 1 atm).
Quindi la pressione atmosferica impedisce al mercurio di cadere totalmente.
La pressione quindi è la forza esercitata su una superficie e si indica in Pascal (Pa) che è uguale a N/m2 .
Per sapere 760 mm Hg (cioè 1 atm) a quanti Pascal corrispondono, supponiamo di avere una lastra di Hg di1m2, alta 1mm, con densità 13,596 g/cm3.
Per calcolare la massa di questa lastra dobbiamo conoscere 424f52e il volume. Il volume della lastra è uguale a : V = 100 cm ∙ 100 cm ∙ 0,100 cm = 1000 cm3 = 1L
La massa di questa lastra sarà: 1000 cm3 ∙ 13,596 g/cm3 = 13596 g = 13,596 Kg
Quindi la pressione sarà:
P = F/m2 = massa ∙ accelerazione
![]() m2
m2
La lastra è sotto posta ad accelerazione di gravità che è uguale a 9,806 m sec-2 e quindi:
![]() 13,596 Kg ∙ 9,806 m sec-2 = 133,32 Pa
13,596 Kg ∙ 9,806 m sec-2 = 133,32 Pa
1m2
Quindi 1mm Hg = 133,32 Pa e quindi 760 mm Hg = 760 ∙ 133,32 Pa = 101323 Pa
Il Bar invece è un multiplo del Pascal, 1Bar = 100000 Pa e quindi 1atm = 1,01323 Bar, il milliBar = 1000 Bar, 1atm = 1013 millibar
La legge di Boyle:
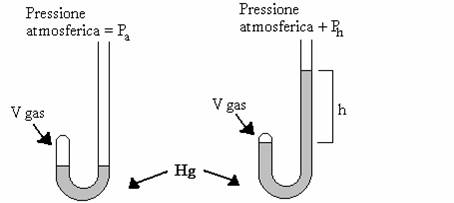
Boyle si proponeva di scoprire se c'era una relazione tra volume
e pressione di un gas, e lo sperimentò attraverso un tubo ad U chiuso ad
un'estremità, dove intrappolo con del mercurio una quantità di gas, all'inizio
graverà sul gas solo la pressione atmosferica, ma se si aggiunge Hg la
pressione sarà data dalla pressione atmosferica più la pressione del mercurio
in eccesso inserito nel tubo.
Boyle ha misurato le variazioni di volume che avvenivano con l'aumento della pressione, riportando i dati ottenuti in una funzione, si ottiene l'equazione generale di una retta, da cui si ottengono le seguenti equazioni:
P ∙ V = R (a T ed n costanti)
V = R/P (a T ed n costanti)
P = R/V (a T ed n costanti)
La legge di Boyle quindi indica che per un dato numero di moli di molecole di gas, se la temperatura è costante, la pressione è inversamente proporzionale al volume.
La legge di Boyle può anche essere scritta come: P1 ∙ V1 = P2 ∙ V2 (dove 1 e 2 rappresentano diverse condizioni).
Legge di Charles:
|
(la scala
assoluta di Kelvin) che parte da -273°C = 0 K.
La legge di Charles si può quindi riassumere nell'equazione: V = R ∙ T (a P ed n costanti)
Che indica che a pressione costante il volume di un dato numero di moli di gas è direttamente proporzionale alla temperatura assoluta.
La legge di Charles si può scrivere anche come:
V1/T1 = V2/T2 oppure V1/V2 = T1/T2
L'equazione di stato dei gas:
Le tre equazioni che descrivono il comportamento dei gas, possono essere scritte in termini di proporzionalità del volume con un'altra grandezza;
Legge di Avogadro: V direttamente proporzionale a n (a P e T costanti)
Legge di Boyle: V inversamente proporzionale a P (a T e n costanti)
Legge di Charles: V direttamente proporzionale a T (a P e n costanti)
![]()
![]() Per cui si deduce
che : V è direttamente proporzionale a n
∙ T , quindi V = R ∙ n ∙ T
Per cui si deduce
che : V è direttamente proporzionale a n
∙ T , quindi V = R ∙ n ∙ T
P P
dove R è la costante di proporzionalità dei gas.
L'equazione di stato dei gas è spesso utile quando viene espressa in termini di rapporto delle condizioni iniziali e finali:
P2/P1 = V1/V2 (T e n cost.) ; V2/V1 = T2/T1 (P e n cost.) ; V2/V1 = n2/n1 (T e V cost.) ;
P1 ∙ V1 = P2 ∙ V2
![]()
![]() T1 T2
T1 T2
Energia Cinetica :
Allo stato gassoso le particelle sono soggette a poche interazioni. A queste particelle sono associabili grandezze quali la pressione la temperatura il volume e il numero di moli.
La teoria cinetica dei gas parte da un modello.
In questo modello noi supponiamo di avere un certo numero di moli (N) con massa (m) che si muovono in un cubo di lato (l), con una velocità di (v) con una temperatura (T).
Le particelle di gas si comporteranno come gas ideale con tali caratteristiche:
Il gas è composto da molecole estremamente lontane l'una dall'altra in confronto alle loro dimensioni. Le molecole possono considerarsi come puntiformi e cioè prive di volume.
Le molecole del gas sono in continuo moto caotico rettilineo e disordinato nella quale urtano tra loro e contro le pareti del recipiente, e gli urti sono elastici cioè non c'è perdita di energia per attrito in seguito all'urto.
Le molecole non risentono di forze di interazione tra di loro o con le pareti del contenitore, all'infuori dell'impatto dovuto alla collisione.
Chiaramente questo non è un modello di un gas reale, poiché esso non rispetterebbe i punti sopraindicati.
![]()

![]()
![]()




![]()


Quindi nel modello la variazione di moto (v), fatta secondo le componenti lungo le tre assi x, y, z del sistema cartesiano, nel tempo non è altro che la forza, che è collegata con la pressione tramite la relazione forza superficie.
Quindi in questo modo abbiamo la componente della forza per le tre direzioni che diviso il tempo ci da (F) cioè la forza.
Possiamo quindi collegare la forza alla pressione lungo le tre componenti, e avremo quindi Forza su superficie o meglio quantità di moto per unità di tempo su superficie, questo termine relaziona già la pressione al volume e poiché si tratta di un gas ideale la pressione sarà la stessa su tutte le pareti per cui Px=Py=Pz=P, come sarà la stessa la velocità di moto sulle pareti.
Questo ci serve per capire che questo sistema ha una sua energia e l'espressione pressione per volume è l'energia di un sistema racchiuso in un cubo, e l'espressione P V è costante per una data velocità media delle molecole del gas. Per una mole di gas il prodotto P V è proporzionale all'energia cinetica per mole. Per cui l'energia cinetica per mole è proporzionale alla temperatura. Da questo si deduce che qualsiasi gas ha la stessa energia cinetica alla stessa temperatura.
In conclusione la temperatura è una misura del moto delle molecole, se riscaldiamo un gas il moto aumenta se lo raffreddiamo diminuisce.
Dimensione e velocità molecolare:
Come abbiamo visto prima la velocità media quadratica è proporzionale al prodotto pressione per volume. La velocità media quadratica è però influenzata dalle dimensioni delle molecole e quindi dalla loro massa.
Quindi mentre i gas hanno la stessa energia cinetica alla stessa temperatura, la velocità quadratica invece cambia perché è funzione della massa molecolare.
Legge di Dalton delle pressioni parziali:
In una miscela di gas considerati ideali, quindi gli urti sulle pareti saranno elastici, le energie cinetiche dei gas che la compongono saranno uguali, per cui l'energia cinetica della miscela sarà data dalla somma delle energie cinetiche dei gas che la compongono.
Se ciascuna molecola di gas si muove indipendentemente è possibile quindi anche calcolare la pressione di ogni singolo gas che compone la miscela.
La pressione parziale è la pressione esercitata da un componente considerato come singolo gas nel dato volume.
La pressione totale della miscela quindi sarà data dalla somme delle pressioni parziali dei componenti individuali della miscela, ciascuno considerato come se fosse l'unico gas presente nel dato volume. Questa legge fu formulata da John Dal ton.
Un modo importante di esprimere la concentrazione delle miscele gassose è la frazione molare (X).
La frazione molare di una sostanza è data dalle moli della sostanza stessa fratto il totale delle moli di tutte le sostanza presenti nella miscela.
Un altro modo di esprimere la legge di Dalton è quella di dire che la pressione parziale di un gas presente in una miscela è pari alla sua frazione molare per la pressione totale.
Il calcolo delle probabilità che una molecola ha di entrare ha di entrare in un foro della parete nella parete di un contenitore, portò alla legge di diffusione di Graham secondo la quale la velocità di diffusione di un gas attraverso un piccolo orifizio di un recipiente è inversamente proporzionale alla radice quadrata del peso molecolare.
Gas reali e deviazioni dell'equazione di stato dei gas:
Per un gas ideale il rapporto PV/RT per una mole di gas è sempre uguale all'unità. Tutti i gas reali deviano chi più chi meno dal comportamento ideale la quantità Z=PV/RT è chiamata coefficiente di compressibilità ed è la misura di questa deviazione.
I gas reali si avvicinano al comportamento dei gas reali solo quando sono rarefatti.
Per i gas reali non possiamo applicare a legge di stato dei gas ideali, poiché le molecole hanno volume proprio e una massa che incide sulla quantità di moto, e quindi la pressione risente del fatto che le molecole hanno volume proprio.
Per i gas reali allora si applica l'equazione di stato di Van der Vaals che è appunto
![]()
![]() (P+a/V2) (V b) = RT
(P+a/V2) (V b) = RT
Questa equazione è sempre l'equazione di stato dei gas con l'aggiunta però di a/V2 e b.
![]() Dove V è il volume per mole ossia il volume molare V/n, mentre a e b
sono le costanti di Van der Vaals.
Dove V è il volume per mole ossia il volume molare V/n, mentre a e b
sono le costanti di Van der Vaals.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025