|
|
| |
LEGAME NEI SOLIDI E NEI LIQUIDI
Solidi elementari:
I solidi che sono tenuti insieme da deboli attrazioni fra le singole molecole sono detti solidi molecolari, ad esempio i gas nobili a temperature basse esistono come solidi molecolari tenuti insieme da deboli forze interatomiche.
Ad esempio elementi alogeni come il bromo cristallizzano a basse temperature dando luogo a solidi molecolari.
Atomi come l'ossigeno e lo zolfo hanno due elettroni mancanti per completare il guscio per cui formeranno due legami covalenti per atomo. A temperatura ambiente l'ossigeno è sottoforma di molecola biatomica mentre lo zolfo possiede diverse strutture atomiche (allotropi) come anelli S8 oppure anelli S6 o catene elicoidali di S.
Atomi invece come l'azoto hanno tre elettroni mancanti per completare il guscio per cui formeranno tre legami covalenti per atomo. Per l'azoto la forma stabile è la molecola biatomica mentre il fluoro è presente come allotropo costituito da unità tetraedriche P4.
Elementi come il carbonio e il silicio avendo due elettroni disaccoppiati ci si aspetta di avere due legami covalenti, ma per poter raggiungere l'ottetto preferiscono formare quattro legami covalenti, come nel diamante e nella grafite.
Diamante e grafite si chiamano solidi a reticolo non metallico poiché consistono in 828b15i un reticolo di atomi legati non si può distinguere nessuna molecola separata da altre molecole simili, per cui ogni solido può essere considerato una grossa molecola legata da legami covalenti, solidi di questo tipo generalmente non sono buoni conduttori né di calore né di elettricità, ma sono solidi molto forti con alti punti di fusione, questa caratteristica è conferita dai forti legami covalenti.
Il boro è l'unico elemento non metallico del suo gruppo e possiede tre forme allotropiche che si basano tutte su unità di B12 che sono icosaedriche, in ogni allotropo gli icosaedri sono legati fra loro in modo diverso, e i legami che legano ogni icosaedro con un altro sono più deboli dei legami interni di ogni icosaedro.
Litio e sodio adottano una struttura cubica a corpo centrato, berillio e magnesio cristallizzano a struttura esagonale compatta, mentre l'alluminio ha una struttura cubica compatta.
Ricapitolando i solidi molecolari possono avere strutture:
Solidi molecolari diatomici con bassi punti di fusione e di ebollizione.
Anelli o catene impacchettate fra loro.
Tetraedri o strati.
Reticolo tridimensionale non metallico.
Icosaedri impacchettati fra loro.
Solidi ionici:
I solidi ionici consistono in una sequenza di ioni positivi e ioni negativi tenuti insieme da forze elettrostatiche.
Come nel sale NaCl dove gli ioni Na+ e gli ioni Cl- sono sistemanti in modo da massimizzare le attrazioni elettrostatiche. In NaCl il numero di coordinazione è 6.
I solidi ionici sono molto forti ne consegue che hanno alti punti di fusione e di ebollizione.
Solidi molecolari e liquidi:
Molecole biatomiche come H2, N2, O2, F2 formano solidi molecolari perché gli elettroni di valenza sono utilizzati per i legami intermolecolari per cui le molecole sono tenute insieme nel solido da deboli forze.
Le deboli forze che tengono insieme i solidi molecolari sono dette forze di Van Der Waals.
Forze di Van Der Waals:
Vi sono due principali forze di Van Der Waals: la repulsione e l'attrazione.
La repulsione avviene a corto raggio (cioè quando le molecole sono troppo vicine).
L'attrazione invece avviene ad una certa distanza fra le molecole, e quando le molecole sincronizzano il loro moto interagendo producono un dipolo istantaneo-dipolo indotto, questo avviene quando una molecola ha la maggior parte della sua densità elettronica da una parte che la rende un piccolo dipolo con una parte negativa e una positiva, che influenzerà la molecola vicina rendendo anch'essa un dipolo indotto.
Le densità elettroniche fluttuano continuamente creando momenti di dipolo, la forza è quantitativamente piccola ma importante fra gli atomi, l'energia risultante da questa forza è detta energia di London.
I solidi molecolari tenuti insieme dalle forze di Van Der Waals fondono generalmente a basse temperature, perché basta un'energia relativamente piccola del moto termico per superare queste forze.
Le forze di Van Der Waals di solito nei solidi molecolari aumentano all'aumentare della grandezza degli atomi.
Molecole polari e legami a idrogeno:
Le molecole polari sono stabilizzate né solido dalle interazioni tra molecole di segno opposto dipolo-dipolo.
Un tipo di legame polare importante è il legame a idrogeno, che è un legame elettrostatico tra un atomo d'idrogeno carico positivamente ed un altro atomo invece più elettronegativo come N, O, F.
Ad esempio nel ghiaccio le molecole sono tenute insieme da legami a idrogeno, infatti, ogni idrogeno è legato ad un ossigeno di un'altra molecola mediante un legame a idrogeno.
Tali legami sono più deboli dei legami covalenti, ma vista la loro grande numerosità li rende dei legami molto importanti (come le forze di Van Der Waals).
Sono proprio questi legami a idrogeno responsabili di molte proprietà dell'acqua quali come i punti alti di fusione e di ebollizione.
Sono anche questi legami che rendono il ghiaccio meno denso dell'acqua questo perché i legami a idrogeno conferiscono al ghiaccio una struttura a reticolo molto aperto.
La natura polare dell'acqua la rende quindi un ottimo solvente capace di separare solidi ionici come NaCl, a causa delle interazioni dipolo-dipolo che attraggono gli ioni del sale vincendo la forza elettrostatica del reticolo cristallino.
Metalli:
I metalli sono solidi che hanno un alta conduttività termica ed elettrica, questo ci fa capire che gli elettroni sono relativamente liberi di muoversi attraverso la struttura cristallina.
Gli atomi metallici hanno generalmente un guscio chiuso per cui la struttura metallica è formata come se le cariche positive fossero tutte immerse in un "mare" di elettroni. Questo spiega anche gli alti punti di fusione dei metalli, perché il "mare" di elettroni lega molto bene le cariche positive nel cristallo.
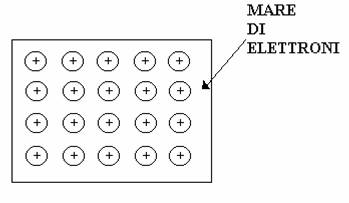
Questa struttura formata dal "mare" di elettroni fornisce altre caratteristiche hai metalli che sono appunto la malleabilità (ridurre in fogli) e la duttilità (ridurre in fili), questo perché il mare di elettroni che si sposta facilmente fa da scudo alle forze repulsive nei metalli, a differenze dei solidi ionici dove gli elettroni sono saldamente legati ai nuclei dell'atomo ed il solido è tenuto dalle forze elettrostatiche, per cui uno spostamento avvicinerebbe le cariche di segno uguale creando una forte repulsione.
Bande elettroniche nei metalli:
Secondo la teoria degli orbitali molecolari l'intero blocco di un metallo si considera come una molecola gigante.
Assumiamo ad esempio di avere un cristallo di litio, formato da 1023 atomi di litio.
Nel litio l'orbitale di valenza è il 2s per cui vi sono ben 1023 orbitali di valenza nel cristallo, dove ogni atomo di litio ha mezzo orbitale 2s pieno.
Con 1023 atomi di litio si vengono a formare tre bande di livelli energetici formate dai tre orbitali del litio, gli orbitali 1s, 2s e 2p, l'1s è completamente pieno per cui non contribuiscono al legame, mentre il 2s è pieno solo per metà, per cui i 1023 orbitali 2s interagiscono per formare una banda di 1023 orbitali delocalizzati, la quale banda nel litio è piena solo per metà.
La presenza di una banda semi piena permette la conduzione di elettroni, infatti, gli elettroni nella banda di orbitali pieni più bassa fluiscono in modo casuale per tutto il cristallo.
Per la conduzione elettrica quindi è necessario che gli elettroni siano eccitati in orbitali delocalizzati vuoti in modo che il loro movimento in una direzione non sia annullato da elettroni che si muovono nella direzione opposta, e questo avviene solo quando si applica una differenza di potenziale in due regioni del metallo.
La conduzione è impedita dalla collisione degli elettroni con le cariche positive, che vibrano all'interno dei siti cristallini, per cui se aumenta la temperatura la vibrazione delle cariche positive aumenta e aumenta anche il numero delle collisioni per cui con l'aumento della temperatura la conduttività diminuisce.
Il berillio ha la banda 2s piena per cui non dovrebbe condurre elettricità, ma in realtà avviene il contrario perché la banda 2p si sovrappone alla 2s e gli elettroni sono liberi di fluire e il metallo quindi conduce elettricità.
Solidi a reticolo non metallico:
I materiali a reticolo non metallico, come il carbonio e il silicio, sono isolanti in quanto non conducono elettricità. Gli elettroni in questi reticoli non sono liberi di muoversi in quanto tutti gli elettroni di valenza sono utilizzati nel legame, questi tipi di solidi hanno generalmente bassi numeri di coordinazione.
In questi tipi di solidi le bande sono separate da una zona proibita o una separazione fra bande, per cui perché gli elettroni fluiscano dalla banda piena alla banda vuota bisogna che superino la zona proibita per cui è necessario fornire un adeguata energia per operare questo salto, per cui soltanto ad alte temperature o con campi elettrici estremamente forti si avrà sufficiente energie per ottenere una conduzione.
Semiconduttori:
Ci sono però strutture di solidi che hanno proprietà intermedie fra gli isolanti e i conduttori, per cui non vi è una separazione netta fra struttura a reticolo metallico e non metallico.
Ad esempio solidi come silicio e germanio hanno la struttura del diamante ma hanno una separazione delle bande molto più piccola rispetto al carbonio, per cui metalloidi del genere sono detti semiconduttori.
Un semiconduttore conduce elettricità se si fornisce l'energia relativamente piccola per far passare gli elettroni nella banda vuota successiva e poiché il numero di elettroni eccitati aumenta con l'aumentare della temperatura, nei semiconduttori la conduttività aumenta all'aumentare della temperatura, che è l'opposto del comportamento dei metalli.
In oltre la conduzione può aumentare in materiali come il silicio e il germanio se si aggiungono piccole quantità di impurità (tipo boro o fosforo), che diminuiscono la separazione tra le bande.
I silicati:
Ogni atomo di silicio è legato covalentemente a quattro atomi di ossigeno ai vertici di un tetraedro, in questo modo i tetraedri possono combinarsi in diversi modi, e cioè condividere un atomo di ossigeno ai vertici oppure formare un anello.
Strutture a catena:
Un altro tipo di legame dei silicati è fatta di filari infiniti o catene di tetraedri legati fra loro, queste catene possono essere separate molto più facilmente dei legami presenti in ogni singolo tetraedro.
Strutture a strati:
Quando queste catene si estendono nel piano si producono strutture planari a strati, ogni strato è tenuto insieme da forze di Van Der Waals per cui gli strati slittano facilmente.
Reticoli tridimensionali:
I reticoli tridimensionali si ottengono quando tutti e quattro gli atomi di ossigeno sono condivisi altri ioni Si4+, come nel quarzo.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025