|
|
| |
Cognome e nome: 717d31h Data dell'esperienza:
Titolazione di un acido forte mediante una base forte
Obiettivo: determinare la concentrazione di acido cloridrico nella sua soluzione, usando il processo di neutralizzazione mediante l'idrossido di sodio
Strumenti e materiali utilizzati:
20 ml di soluzione acquosa di HCl
50 ml di soluzione acquosa di NaOH 0,25 M
fenolftaleina
3 burette da ml dotate di scala graduata con sensibilità pari a ± 0,05 ml, e suddivise in tacche da 0,1 ml
1 beuta da 150 ml
1 becher
base di sostegno
Premessa: per titolare un acido forte è possibile utilizzare la reazione di neutralizzazione con una base forte di concentrazione (o titolo) nota, e quindi al fine di titolare l'HCl si ricorre all'uso della base forte: NaOH. L'esperienza consiste quindi nel rilevare quanto volume di NaOH sarà necessario per giungere al punto di viraggio, cioè quanto NaOH bisognerà aggiungere alla soluzione acquosa di HCl per completare la reazione di neutralizzazione. Per capire quando la soluzione da titolare avrà raggiunto il punto di viraggio sarà necessario usare un indicatore: la fenolftaleina avente punto di viraggio pari a pH = 8,9, e di colore viola in soluzione basiche con pH maggiore al punto di viraggio. Grazie a questo indicatore la soluzione quando si troverà vicino al punto di viraggio e quindi compiuta la neutralizzazione si colorerà di un leggero rosa, che cambierà in violetto se verranno aggiunte poche altre gocce di NaOH.
Descrizione della procedura: da una buretta contenente la soluzione acquosa NaOH 0,25 M, si prelevano con il becher, 50 ml di soluzione controllando il volume del liquido per mezzo della scala graduata della buretta. Successivamente dalla buretta contente la soluzione acquosa di HCl, si prelevano con la beuta, 20 ml e sempre nella beuta si versano 2-3 gocce di fenolftaleina. Si prende la terza buretta e la si avvina con po' di NaOH, tenendo conto che serviranno almeno 30 ml per la realizzazione dell'esperienza; terminata questa operazione le si versa al suo interno l'NaOH rimanente e si fissa la buretta ad una base di sostegno. Dopo aver annotato il volume iniziale di NaOH nella buretta, si procede ponendo la beuta contente HCl in corrispondenza della terza buretta. A questo punto molto lentamente si apre il rubinetto della buretta curando che l'NaOH scenda lentamente per gocce singole nella beuta contente HCl; occorre inoltre fare attenzione al fatto che le gocce cadano direttamente nella soluzione acida e non sulle pareti della beuta. Ad ogni goccia caduta bisogna mescolare la soluzione agitando la beuta con una mano, mentre l'altra è impegnata a controllare il rubinetto della beuta. Il rubinetto si chiude non appena nonostante l'aver mescolato la beuta, la soluzione rimane di un colore rosato; a questo punto occorre rilevare la concentrazione finale di NaOH. Infine una volta calcolato il volume di NaOH con una serie di rapporti illustrati in seguito si potrà calcolare la concentrazione di HCl
Dati:
Volume della soluzione di HCl: 20 ml
Concentrazione della soluzione di NaOH: 0,25 mol dm-3
lettura iniziale della buretta: 15,0 ml
lettura finale della buretta: 30,7 ml
Elaborazione dati:
si calcola il volume di soluzione di NaOH usato, come differenza fra le due letture:
VNaOH 15,0 ml - 30,5 ml | = 15,7 ml
Si scrive l'equazione bilanciata per la reazione di neutralizzazione
![]() NaOH + HCl NaCl + H2O
NaOH + HCl NaCl + H2O
Si calcola il numero di moli di NaOH contenuti in 15,7 ml di soluzione 0,25 M, tenendo presente che 15,7 ml = 15,7 · 10-3 dm3
nNaOH = (15,7 · 10-3 dm3) (0,25 mol dm-3) = 3,93 · 10-3 mol
Questo è anche il numero di moli di HCl contenute in 20 ml (= 20,0 · 10-3 dm3) di HCl
nNaOH = nHCl
A questo punto è possibile clacolare la concentrazione della soluzione di HCl:
[HCl] = 3,93 · 10-3 mol / 20,0 · 10-3 dm3 = 0,20 mol dm-3
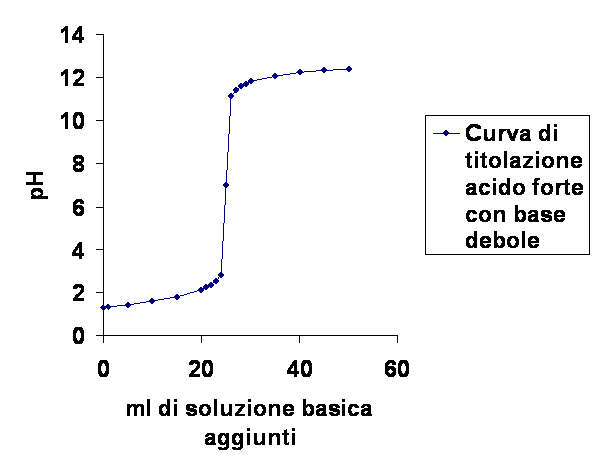
Conclusioni: La concetrazione di HCl è 0,20 M. Questo dato può non essere corretto in quanto nel determinare il punto di viraggio durante l'esperienza si sono versate alcune gocce in più del necessario e ciò è provato dal fatto che l'esperienza del mio gruppo di lavoro si è concluso con una colorazione viola della soluzione. Il fatto che siano bastate poche gocce per rendere completamente basica la soluzione di HCl è dovuto alla particolare reazione di neutralizzazione che avviene tra un acido e una base forte, infatti osservando la curva di titolazione si noterà che il pH varia pochissimo inizialmente, ad ogni aggiunta di base sino a che non ci si avvicina al punto di viraggio. In vicinanza del punto di viraggio, invece l'aggiunta di una quantità molto piccola di base provoca una variazione molto marcata del pH, segnando il passaggio da una soluzione acida a una soluzione neutra e, immediatamente dopo, a una basica. Questo comportamento determina in prossimità del punto di viraggio un picco notevole nella curva di titolazione.
La curva di titolazione seguente non è quella dell'acido usato nell'esperienza, ma è analoga a quella che si potrebbe realizzare se si fossero raccolti più dati in questa esperienza.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025