|
|
| |
|
|
Laboratorio di ChimicaEsperienza : Solubilità e miscibilità |
L'esperienza si basa sui concetti di solubilità e miscibilità. L'affermazione il simile scioglie il simile fornisce un'utile criterio per valutare la solubilità di un solido in un dato solvente o la miscibilità di due liquidi. Per capire meglio questi due fenomeni è tuttavia necessario prendere in esame fattori termodinamici entropici ed entalpici quali i calori di dissoluzione (che derivano dalla somma di diversi fattori energetici: le interazioni intermolecolari, le energie reticolari, i calori di solvatazione). La seguente esperienza si articola in tre parti:
NOTA: I solventi organici devono essere utilizzati sotto cappa
PARTE A - Prove di solubilità
Verifica della solubilità dei seguenti composti (soluti) nei diversi solventi indicati.
|
Solido |
Solvente |
|
|
|
|
|
|
|
|
Per effettuare le prove di solubilità si proceda come segue:
a) si prenda un provetta pulita ed asciutta;
b) si versi nella provetta una punta di spatola del solido e si aggiungano 1-2 mL del solvente;
c) si agiti ripetutamente e con decisione la provetta;
d) si osservi quanto accade e si prenda nota nel quaderno.
PARTE B - Prove di miscibilità
Verificare la miscibilità reciproca dei solventi utilizzati nella parte A. Si proceda verificando la miscibilità di tutte le possibili coppie di solventi (2 mL di ogni solvente in provetta) e completare la tabella seguente:
|
|
Acqua |
Cloroformio |
Metanolo |
Etere di Petrolio |
|
Acqua |
X |
|
|
|
|
Cloroformio |
|
X |
|
|
|
Metanolo |
|
|
X |
|
|
Etere di Petrolio |
|
|
|
X |
PARTE C - Solubilità e miscibilità
Si proceda come segue, prendendo nota di quanto osservato:
a) Versare 5 mL di cloroformio nel provettone. Aggiungere 5 mL di acqua, osservare.
b) Aggiungere una spatolata di solfato di rame. Agitare ripetutamente e con decisione la provetta, osservare.
c) Aggiungere lentamente 10 mL di etere di petrolio, osservare.
d) Agitare come al punto b) e osservare.
|
|
Laboratorio di ChimicaEsperienza 1b: Reazioni Chimiche in Soluzione |
Reazioni in soluzione
Alcuni tipi di reazioni ioniche, che non implicano processi di ossido-riduzione, possono essere previste sulla base di considerazioni molto semplici. Si avrà una reazione se in soluzione ci sono degli ioni che possono dar luogo ad un sale insolubile, ad un elettrolita debole (o ad un non-elettrolita) o infine ad un gas. Questa esperienza si prefigge almeno due obiettivi:
Per ognuna delle reazioni elencate procedi come segue:
Test: odore di acido acetico prima e dopo il mescolamento.
Test: odore di acido acetico prima e dopo il mescolamento.
Test: odore di NH3 prima e dopo il mescolamento.
Prelevare una microscaglietta di Na2S. Test: odore di H2S.
Per quanto riguarda il nitrato d'argento, è consigliabile usarne solo poche gocce da bottigliette provviste di contagocce.
TABELLA A
REGOLE Dl SOLUBILITÁ DEI SALI ED IDROSSIDI PIÚ COMUNI
Sono solubili:
(L'acetato di Ag+ ed il perclorato di K+ sono moderatamente solubili).
i solfati di Ca2+ ed Ag+ sono moderatamente solubili;
i solfati di Sr2+, Ba2+, Pb2+,ed Hg22+ sono insolubili.
Sono insolubili (Eccetto i sali del precedente punto 1):
CaO + H2O → Ca2+ + 2OH-
TABELLA B
Elettroliti forti
Acidi forti es. HCl, HBr, HI, HNO3, H2SO4, HClO4.
Basi forti es. gli idrossidi alcalini ed alcalino terrosi.
Sali la maggior parte dei sali inorganici ed organici.
Elettroliti deboli
La grande maggioranza di acidi e basi inorganici ed organici.
Gli alogenuri e i cianuri di metalli pesanti, per es. Pb ed Hg, sono spesso elettroliti deboli
Non-elettroliti
acqua.
La grande maggioranza dei composti organici.
TABELLA C
GAS E SOLUZIONI ACQUOSE
CO2: CO32- + 2H+ → H2CO3 → CO2(g) + H2O
H2S: S2- + 2H+ → H2S(g)
SO2: SO32- + 2H+ → H2SO3 → SO2(g) + H2O
NO, NO2: 2NO2- + 2H+ → 2HNO2 → H2O + NO(g) + NO2(g)
NH3: NH4+ + OH- → NH3(g) + H2O
|
|
Laboratorio di ChimicaEsperienza 2:Preparazione di soluzioni a titolo noto |
Obiettivi operativi:
Uso pratico di una bilancia di precisione;
Uso pratico delle pipette graduate, tarate e matracci tarati;
Preparazione di soluzioni a titolo noto, da sostanze madri e da soluzioni più concentrate.
PARTE A - Preparazione di una soluzione di NaCl a partire da NaCl solido
In relazione alla vetreria disponibile, preparare 50 o 100 mL di una soluzione di NaCl 0.05 M
DM/M = Dn/n + DV/V = Dg/g + DV/V
g = ; Dg = ; V = ; DV = ; M = ; DM =
M = ±
PARTE B - Preparazione di una soluzione di fertilizzante
Si vogliono preparare 50 g di una soluzione di concime al 2.2% di fosforo e 3.6% di potassio in peso, impiegando NaH2PO4 e KNO3. Per calcolare le quantità dei due sali è necessario riferirsi al peso totale della soluzione; la quantità di acqua occorrente verrà determinata per differenza. Si hanno così a disposizione tutte le grandezze necessarie per il calcolo della molalità.
Per l'impiego pratico come fertilizzante, la soluzione deve essere diluita 1 a 100.
Per l'esecuzione, si proceda come segue:
a) si calcolino le quantità occorrenti di KNO3, NaH2PO4 ed H2O;
b) si pesino i sali direttamente nel recipiente di preparazione;
c) si aggiunga il solvente e si agiti fino a completa dissoluzione dei soluti.
Calcolare la concentrazione molale dei soluti nella soluzione:
m = nsoluto/Kgsolvente
Dm/m = Dnsoluto/nsoluto + DKgsolv/Kgsolv = Dgsoluto/gsoluto + Dgsolv/gsolv
gNaH2PO4 ; Dg = ; gKNO3 = ; Dg = ; gH2O ; Dg =
m NaH2PO4 ; Dm NaH2PO4 ; m KNO3 ; Dm KNO3 ;
m NaH2PO4 ± m KNO3 ±
PARTE C - Preparazione di soluzioni di HCl a partire da una soluzione più concentrata
In relazione alla vetreria disponibile, a partire da una soluzione di HCl 0.1 M, preparare:
50 o 100 mL di una soluzione di HCl 0.01 M
50 o 100 mL di una soluzione di HCl 0.001 M
Ricordando che Mi · Vi = Mf · Vf, si calcoli il volume Vi di HCl 0.1M che occorre prelevare. Si prelevi con una pipetta tarata il volume calcolato Vi e lo si porti al volume finale Vf con acqua distillata nel matraccio. Per ogni soluzione si calcoli l'errore commesso nella preparazione.
DM/M = Dn/n + DVf/Vf = DMi/Mi + DVi/Vi + DVf/Vf
Per semplicità si consideri la concentrazione della soluzione 0.1 M priva di errore, ovvero DMi/Mi= 0
M = ±
Calcolare il pH teorico delle due soluzioni preparate (pH = -log [H+]; [H+] = 10-pH) e verificare con un pH-metro che il pH sperimentale corrisponda a quello teorico.
|
|
Laboratorio di ChimicaEsperienza : Titolazione Acido Forte/Base Forte |
Scopo della presente esperienza è l'esecuzione di una titolazione acido/base. In questo caso si determinerà il titolo (ovvero la concentrazione) di una soluzione di HNO3 mediante una soluzione di NaOH 0.10±0.01M titolo, secondo la reazione:
HNO3(aq) + NaOH(aq) NaNO3(aq) + H2O(l)
Poiché HNO3 è un acido forte e NaOH una base forte, tale reazione è quantitativa. Pertanto, nota la concentrazione della base, è possibile risalire alla concentrazione dell'acido dal volume di base impiegato. Si definisce punto di equivalenza lo stadio in cui la quantità di titolante aggiunto è stechiometricamente equivalente alla quantità di analita presente nella soluzione da titolare. Per una reazione acido/base in rapporto stechiometrico 1:1, questa condizione si verifica quando è stato aggiunto un numero di moli di titolante pari al numero di moli presenti nella soluzione da titolare. Per una reazione acido forte/base forte, si verifica un elevata variazione di pH in corrispondenza del punto di equivalenza. Pertanto è possibile impiegare un indicatore di pH per evidenziare il raggiungimento del punto di equivalenza, purché l'intervallo di viraggio dell'indicatore (generalmente pKInd ± 1) risulti interamente compreso all'interno dell'intervallo di variazione di pH corrispondente al raggiungimento del punto di equivalenza. Per una titolazione come quella in esame possono impiegarsi i seguenti indicatori:
pH Colorazione
a) Fenolftaleina 8.2 - 10.0 incolore - violetto
b) Blu di bromotimolo 6.0 - 7.6 giallo - blu
c) Rosso di metile 4.4 - 6.2 Rosso - giallo
Prelevare con la pipetta automatica 20 mL della soluzione di HNO3 e porli nel becker. Aggiungere 80 mL di acqua distillata e 2-3 gocce di indicatore. Avvinare la buretta e riempirla con la soluzione di NaOH 0.10±0.01M. Azzerare poi la buretta controllando che non vi siano bolle d'aria. Tenendo la soluzione sotto agitazione, aggiungere goccia a goccia la soluzione di base fino a viraggio dell'indicatore. Prendere nota del volume aggiunto, e ripetere la titolazione altre due volte.
Calcolare la media dei tre valori di volume ottenuti, ed il titolo della soluzione di HNO3, compresa l'incertezza sperimentale DM.
Qual è la concentrazione della soluzione di HNO3 ?
[HNO3] = _________________ ± ______________ M
|
|
Laboratorio di ChimicaEsperienza 4a:Titolazione potenziometrica dell'acido fosforico |
L'acido fosforico H3PO4 è un acido debole nella prima e nella seconda dissociazione e molto debole nella terza. Nel corso di una titolazione con una base forte si verificano nell'ordine le seguenti reazioni:
H3PO4(aq) + OH-(aq) H2PO4-(aq) + H2O(l) Ka1 = 7.1 10-3
H2PO4-(aq) + OH-(aq) HPO42-(aq) + H2O(l) Ka2 = 6.2 10-8
HPO42-(aq) + OH-(aq) PO43-(aq) + H2O(l) Ka3 = 4.4 10-13
dove la 3) è individuabile con difficoltà per via potenziometrica.
Procedimento
Prelevare con una pipetta 1.00 mL di H3PO4 ~ 1M, addizionare 100 mL di H2O (accertarsi che l'elettrodo sia coperto) e titolarli con NaOH 0.1M. Effettuare la titolazione aggiungendo le quantità indicate di NaOH e segnando il pH misurato in corrispondenza ad ogni aggiunta.
|
mL NaOH |
pH |
DpH/DV |
mL NaOH |
pH |
DpH/DV |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tracciare il grafico della curva di titolazione pH contro i mL NaOH aggiunti.
Tracciare il grafico in derivata prima DpH/DV contro i mL NaOH aggiunti
Determinare per via grafica i punti di equivalenza
Primo punto di equivalenza: mLNaOH =
Secondo punto di equivalenza: mLNaOH =
[H3PO4] = ± M
|
|
Laboratorio di ChimicaEsperienza 4b: Titolazione Conduttometrica Acido Forte/Base Forte |
Le titolazioni conduttometriche si basano sulla variazione della conduttanza della soluzione nel corso di una reazione (neutralizzazione, precipitazione, etc.). Se la conduttanza dei prodotti della reazione è molto diversa da quella degli ioni che vi partecipano, registrando il valore di conduttanza della soluzione e riportandolo in grafico in funzione del volume di titolante aggiunto, è possibile utilizzare la variazione della conduttività per individuare il punto di equivalenza o di fine della titolazione. Poiché le aggiunte di titolante provocano delle variazioni nel volume della soluzione, i valori di conduttanza misurati devono essere corretti per la diluizione:
![]()
dove V è il volume iniziale della soluzione e v è il volume di titolante aggiunto.
Titolazione acido forte/base forte
Nel caso della titolazione di un acido forte con una soluzione di base forte, la conduttanza diminuisce ad ogni aggiunta di base a causa della sostituzione degli ioni H3O+ con cationi aventi mobilità inferiore. Quando tutti gli ioni H3O+ sono stati neutralizzati (punto di equivalenza) ogni ulteriore aggiunta di base forte genera un aumento della concentrazione di ioni OH- e quindi un aumento della conduttanza misurata. Riportando in grafico la conduttanza misurata (corretta per la diluizione) in funzione del volume di titolante aggiunto, sarà possibile tracciare due rette, aventi pendenza opposta, in corrispondenza delle due serie di punti prima e dopo il punto di equivalenza. L'intersezione delle due rette individua il punto equivalente.
Parte Sperimentale
Prelevare con una pipetta tarata 20.00 mL di HNO3 a titolo approssimato di 0.1M e disporli in un becker da 100 mL. Aggiungere con una pipetta tarata 20.00 mL di H2O, immergere la cella conduttometrica e titolare con NaOH 0.3 M facendo 19 aggiunte da 0.50 mL e 3 da 1 mL.
Registrare il valore di conducibilità dopo
ogni aggiunta e correggerlo per il fattore ![]() , dove V è il volume prima dell'aggiunta e v il volume aggiunto.
, dove V è il volume prima dell'aggiunta e v il volume aggiunto.
|
mL NaOH |
kmisurata |
kcorretta |
mL NaOH |
kmisurata |
kcorretta |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Riportare in un grafico la conducibilità corretta contro i mL di NaOH aggiunti e determinare il punto equivalente.Quindi determinare la molarità dell'acido di partenza.
|
|
Laboratorio di ChimicaEsperienza 5a: determinazione della durezza totale di un'acqua (Ca2+ + Mg2+) |
Si suole chiamare durezza dell'acqua la quantità di ioni metallici in essa presenti. Nelle acque naturali, ad eccezione di quelle marine, il calcio e il magnesio sono i cationi presenti in concentrazione più alta, in particolare sotto forma di carbonati, bicarbonati e solfati. I bicarbonati di calcio e magnesio, a temperatura ambiente, sono solubili in acqua ma, a temperature elevate, precipitano formando incrostazioni. La durezza dovuta a questi sali di Ca e Mg è detta temporanea, perchè è eliminabile con l'ebollizione, secondo la reazione:
![]()
La durezza dovuta invece agli altri sali (cloruri, solfati), eliminabile solo tramite processi di addolcimento, è detta permanente. La somma delle due è la durezza totale, e coincide con il contenuto totale di calcio e magnesio. Le unità di misura della durezza sono:
- i gradi francesi; 1 grado francese corrisponde a 10 mg/L di CaCO3;
- i gradi tedeschi; 1 grado tedesco corrisponde a 10 mg/L di CaO;
Quindi, dato che la massa molecolare del CaCO3 è quasi esattamente 100, se in un'acqua c'è una concentrazione totale di calcio e magnesio pari a 0.01 M, questa corrisponde ad una concentrazione di CaCO3 pari a 1000 ppm, e quindi ad una durezza pari a 100° francesi.
|
Classificazione |
Durezza in gradi francesi |
|
Acqua molto dolce |
|
|
Acqua dolce |
|
|
Acqua a durezza media |
|
|
Acqua a durezza discreta |
|
|
Acqua dura |
|
|
Acqua molto dura |
>30 |
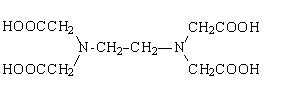 La determinazione della durezza totale si effettua mediante una
titolazione chelometrica, basata cioè sulla formazione quantitativa di
un complesso fra i cationi metallici ed un opportuno legante. Per la
determinazione degli ioni Ca2+ e Mg2+ si adopera come
legante l'EDTA (acido etilendiamminotetracetico, H4Y), in commercio
nella sua forma biprotonata (H2Y2-) come sale bisodico.
L'EDTA è una molecola anfotera, disponendo di quattro gruppi acidi (i quattro
gruppi carbossilici) e due basici (gli atomi di azoto). Il maggiore potere
chelante si ha per la forma completamente deprotonata Y4-. Pertanto,
per garantire la presenza dell'EDTA nella forma tetrabasica ed evitare che il
pH vari durante la titolazione, si deve tamponare la soluzione a pH 10.
La determinazione della durezza totale si effettua mediante una
titolazione chelometrica, basata cioè sulla formazione quantitativa di
un complesso fra i cationi metallici ed un opportuno legante. Per la
determinazione degli ioni Ca2+ e Mg2+ si adopera come
legante l'EDTA (acido etilendiamminotetracetico, H4Y), in commercio
nella sua forma biprotonata (H2Y2-) come sale bisodico.
L'EDTA è una molecola anfotera, disponendo di quattro gruppi acidi (i quattro
gruppi carbossilici) e due basici (gli atomi di azoto). Il maggiore potere
chelante si ha per la forma completamente deprotonata Y4-. Pertanto,
per garantire la presenza dell'EDTA nella forma tetrabasica ed evitare che il
pH vari durante la titolazione, si deve tamponare la soluzione a pH 10.
![]()
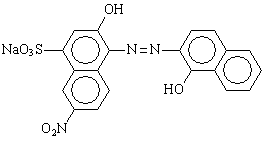 Per evidenziare il punto di equivalenza della titolazione, si usa un
indicatore metallocromico, il NET (nero eriocromo T) un composto organico usato
nella sua forma monobasica come sale sodico (NaH2D). Il NET ha una
colorazione blu quando è presente in soluzione nella sua forma non complessata,
mentre ha una colorazione rosso vinaccia quando è presente del magnesio in
soluzione. La colorazione rossa è dovuta al complesso che il NET forma con lo
ione Mg2+. Poiché la costante di formazione di tale complesso è
molto inferiore rispetto a quella relativa al complesso con l'EDTA, la
titolazione consiste nella reazione di spostamento:
Per evidenziare il punto di equivalenza della titolazione, si usa un
indicatore metallocromico, il NET (nero eriocromo T) un composto organico usato
nella sua forma monobasica come sale sodico (NaH2D). Il NET ha una
colorazione blu quando è presente in soluzione nella sua forma non complessata,
mentre ha una colorazione rosso vinaccia quando è presente del magnesio in
soluzione. La colorazione rossa è dovuta al complesso che il NET forma con lo
ione Mg2+. Poiché la costante di formazione di tale complesso è
molto inferiore rispetto a quella relativa al complesso con l'EDTA, la
titolazione consiste nella reazione di spostamento:
MgNET + EDTA MgEDTA + NET
rosso incolore incolore blu
Durante la titolazione, poiché la costante di formazione del complesso fra Ca2+ ed EDTA è maggiore di quella fra Mg2+ ed EDTA, viene prima titolato lo ione calcio, poi il magnesio, ed il punto di fine è indicato dalla variazione del colore dell'indicatore dal rosso vinaccia a blu.
Prelevare direttamente nel becker 50 mL di acqua con la buretta automatica. Aggiungere 2.5 mL di soluzione tampone a pH 10[1] ed una punta di spatola di indicatore NET. Riscaldare leggermente la soluzione. Riempire la buretta con la soluzione di EDTA a titolo noto. Azzerare la buretta. Tenendo la soluzione sotto agitazione, aggiungere goccia a goccia la soluzione di EDTA fino a viraggio dell'indicatore dal rosso vinaccia al blu. Prendere nota del volume aggiunto, e ripetere la titolazione altre due volte.
Calcolare la media dei tre valori di volume ottenuti, e la concentrazione degli ioni Ca2+ e Mg2+. Esprimere i risultati come mg/L di CaCO3, come gradi francesi e tedeschi.
Concentrazione EDTA: __________ ± ________ M
Volume di acqua: __________ ± ________ mL
Volume di EDTA impiegato: __________ ± ________ mL
Moli di EDTA utilizzate: __________ ± ________ mol
Massa di CaCO3 corrispondente alle moli totali: __________ ± ________ g
pari a __________ ± ________ mg
Concentrazione CaCO3: __________ ± ________ mg/L
Durezza dell'acqua: __________ ± ________ gradi francesi
__________ ± ________ gradi tedeschi
L'acqua analizzata è: molto dolce
(barrare una sola casella) dolce
a durezza media
a durezza discreta
dura
molto dura
|
|
Laboratorio di ChimicaEsperienza 5b Determinazione dello ione calcio in presenza dello ione magnesio in un campione di acqua |
![]() Il calcio
può essere determinato effettuando la titolazione con EDTA a pH
sufficientemente elevato (pH= 12-13) da allontanare il magnesio, precipitandolo
come Mg(OH)2. Inoltre occorre adoperare un indicatore che reagisca
solo con il calcio, quale ad esempio il calcon.
Il calcio
può essere determinato effettuando la titolazione con EDTA a pH
sufficientemente elevato (pH= 12-13) da allontanare il magnesio, precipitandolo
come Mg(OH)2. Inoltre occorre adoperare un indicatore che reagisca
solo con il calcio, quale ad esempio il calcon.
Procedimento
A 50.00 mL
di un campione di acqua 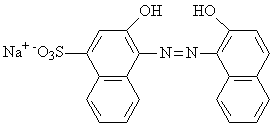 prelevati
con una pipetta tarata aggiungere ~ 6 mL di soluzione NaOH 6M (il pH finale della soluzione deve
essere compreso tra 12 e 12.5 in maniera da precipitare completamente il magnesio
come idrossido) e una punta di spatola di indicatore calcon.
prelevati
con una pipetta tarata aggiungere ~ 6 mL di soluzione NaOH 6M (il pH finale della soluzione deve
essere compreso tra 12 e 12.5 in maniera da precipitare completamente il magnesio
come idrossido) e una punta di spatola di indicatore calcon.
Titolare con una soluzione 0.01M di EDTA fintanto che il colore della soluzione passa dal rosa a blu.
Determinare la quantità di calcio presente nell'acqua ed anche la quantità di magnesio utilizzando i dati dell'esperienza 6a.
Concentrazione EDTA: __________ ± ________ M
Volume di acqua: __________ ± ________ mL
Volume di EDTA impiegato (media di due titolazioni): __________ ± ________ mL
Moli di EDTA utilizzate: __________ ± ________ mol
Milligrammi di calcio __________ ± ________ mg
Concentrazione Ca __________ ± ________ mg/L
Concentrazione Mg __________ ± ________ mg/L
|
|
Laboratorio di ChimicaEsperienza Estrazione della caffeina dalle foglie di tè |
Scopo della presente esperienza è acquisire familiarità con i metodi di separazione (filtrazione, estrazione, evaporazione), di purificazione (cristallizzazione) e di caratterizzazione (spettroscopia UV-visibile).
Procedimento
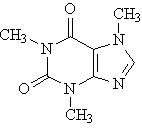 La caffeina, ovvero
la 1,3,7-trimetilxantina, è una sostanza presente sia nei grani di caffè sia
nelle foglie del tè. È un noto stimolatore del sistema nervoso centrale e del
sistema respiratorio. È inoltre uno stimolatore cardiaco, provoca il
rilassamento dei muscoli lisci e la dilatazione delle coronarie. Per separare
la caffeina dalla cellulosa, che è il principale componente delle foglie di tè,
le foglie vengono bollite in acqua. La soluzione acquosa alla fine
dell'operazione di estrazione contiene, oltre alla caffeina, tannini,
clorofilla e pigmenti flavonoidi bruni. Durante l'estrazione si aggiunge
carbonato di calcio, che ha la funzione di formare sali di calcio insolubili
delle sostanze acide, liberando la caffeina che poi verrà estratta in un
solvente organico (cloroformio). Poiché anche la clorofilla è solubile in
cloroformio, la caffeina grezza presenterà una leggera colorazione verde. Dopo
purificazione per ricristallizzazione da acetone, la caffeina pura verrà
caratterizzata attraverso spettrofotometria Uv-visibile.
La caffeina, ovvero
la 1,3,7-trimetilxantina, è una sostanza presente sia nei grani di caffè sia
nelle foglie del tè. È un noto stimolatore del sistema nervoso centrale e del
sistema respiratorio. È inoltre uno stimolatore cardiaco, provoca il
rilassamento dei muscoli lisci e la dilatazione delle coronarie. Per separare
la caffeina dalla cellulosa, che è il principale componente delle foglie di tè,
le foglie vengono bollite in acqua. La soluzione acquosa alla fine
dell'operazione di estrazione contiene, oltre alla caffeina, tannini,
clorofilla e pigmenti flavonoidi bruni. Durante l'estrazione si aggiunge
carbonato di calcio, che ha la funzione di formare sali di calcio insolubili
delle sostanze acide, liberando la caffeina che poi verrà estratta in un
solvente organico (cloroformio). Poiché anche la clorofilla è solubile in
cloroformio, la caffeina grezza presenterà una leggera colorazione verde. Dopo
purificazione per ricristallizzazione da acetone, la caffeina pura verrà
caratterizzata attraverso spettrofotometria Uv-visibile.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025