|
|
| |
Relazione:
Le Reazioni Chimiche
Introduzione sull'argomento: in queste ultime esperienze effettuate in laboratorio abbiamo avuto la possibilità, grazie alla professoressa di Scienze della Materia e all'aiuto dei nostri valorosi tecnici, di comprendere a pieno le trasformazioni fisiche e le t 636b12g rasformazioni chimiche con le loro relative leggi. Da ciò abbiamo potuto verificare il comportamenti della materia sottoposta a una reazione chimica e abbiamo potuto fare un confronto fra le varie leggi che interessavano questa parte dello studio delle Scienze della Materia, e al tutto sono stati aggiunti esempi, confronti, statistiche e prove pratiche che sono state esposte oralmente e praticamente dalla professoressa e dai tecnici che prestano servizio nel nostro istituto.
Abbiamo perciò potuto verificare sperimentalmente la legge di Lavoisier (o della conservazione delle masse), la legge di Proust (o delle proporzioni costanti), e la legge di Dalton (o delle proporzioni multiple).
1a ESPERIENZA
Proprietà di una Reazione Chimica
Obiettivo: dimostrare sperimentalmente le proprietà di una reazione chimica.
Materiali:
Procedimento: dopo esserci muniti di tutti i materiali necessari per sperimentare l'esperienza, abbiamo preso il reagente che in questo caso si trattava del Solfato di Calcio penta Idrato (CaSO45H2O), una stanza dal caratteristico colore blu da cui d'ora in poi per semplificare la situazione chiameremmo come sostanza blu, e ne abbiamo pesato sulla bilancia elettronica prima 4g i quali sono poi stati deposti nella 1a Capsula di porcellana e poi 8g che abbiamo depositato nella 2a Capsula di Porcellana. Successivamente abbiamo montato l'asta tre piedi con morsetto ad anello nel quale abbiamo poggiato la reticella spandi fiamma e in cui al di sotto di essa abbiamo disposto il bunsen, dopo di ché abbiamo posizionato sopra la reticella le due capsule di porcellana con la relativa quantità di reagente, e le abbiamo fatto riscaldare per qualche minuto. Dopo aver atteso qualche minuto dando tempo alla sostanza blu che era disposta all'interno delle due capsule di porcellana di poter reagire bene (ci potevamo accorgere se la sostanza aveva reagito dal cambiamento del colore) abbiamo notato che la sostanza blu per l'appunto aveva cambiato colore ed era diventata bianca e che dopo averla posta a una nuova pesata sulla bilancia elettronica il suo peso era calato, ciò e dovuto al fatto che durante la fase di riscaldamento nel reagente si sono dispersi i gas. Per provare l'esattezza di ciò, abbiamo preso un becher e l'abbiamo riempito con Acqua (H2O) e con l'aiuto della pipetta ne abbiamo versato qualche millilitro sulla sostanza diventata ormai bianca, e dopo aver atteso qualche secondo abbiamo notato che la sostanza stava man mano tornando del suo colore originario cioè blu, ciò e dovuto al fatto che durante il riscaldamento la sostanza blu a perso alcuni dei gas che sono contenuti anche nell'acqua e sono andati cosi a reintegrarsi.
Conclusione: abbiamo potuto individuare le proprietà della reazione chimica, nel caso della sostanza blu il peso era calato perché si sono dispersi i gas, e il peso era cambiato proporzionatamente sia nella 1a che nella 2a Capsula di Porcellana (vedi tabella sottostante) inoltre il colore era cambiato passando dal blu al bianco, in quest'ultima sostanza bianca abbiamo potuto invertire nuovamente la reazione chimica grazie all'aggiunta dell'acqua che ha introdotto dei gas che durante il riscaldamento erano andati a perdersi dalla sostanza blu.
|
|
SOSTANZA BLU (g) |
SOSTANZA BIANCA (NUOVA) (g) |
|
|
4 g 8 g |
2,6 g 5,3 g |
2a ESPERIENZA
Obiettivo: dimostrare sperimentalmente la legge di Lavoisier (indagare sul comportamento della massa durante una trasformazione chimica) la quale afferma che: in un sistema chimico isolato, la somma delle masse delle sostanze che reagiscono tra loro (reagenti) è uguale alla somma delle masse delle sostanze che si formano (prodotti).
Materiali:
Procedimento: dopo esserci muniti di tutti i materiali necessaria per sperimentare l'esperienza, abbiamo pesato il cilindro graduato (108 g) al cui interno abbiamo versato 50 g d'acqua che abbiamo pesato spesando la tara del cilindro nella bilancia elettronica e abbiamo poi travasato il tutto all'interno della beuta e successivamente abbiamo pesato la pastiglia effervescente (6 g) e l'abbiamo poi messa dentro alla beuta con l'acqua, abbiamo subito tappato con un tappo (16 g) in modo che non si disperdessero i gas e abbiamo effettuato la somma totale della beuta e abbaimo ottenuto come peso 180 g.
Infine abbiamo rieffettuato la pesata della beuta dopo che la pastiglia si era disciolta nell'acqua e abbiamo nuovamente ottenuto il peso totale di 180 g.
Conclusione: abbiamo potuto notare che sia la prima che la seconda pesata erano identiche perciò si è verificata esattamente la legge di Lavoisier prima enunciata.
3a ESPERIENZA
Reazione chimica fra Nitrato di Piombo e Ioduro di Potassio
Obiettivo: dimostrare sperimentalmente la legge di Lavoisier che afferma che: in un sistema chimico isolato, la somma delle masse delle sostanze che reagiscono tra loro (reagenti) è uguale alla somma delle masse delle sostanze che si formano (prodotti).
Materiali:
Procedimento: dopo esserci muniti nuovamente di tutti i materiali necessaria per sperimentare l'esperienza, abbiamo preso il 1° cilindro da 50 ml e abbiamo versato all'interno di esso 0,5 M di Ioduro di Potassio, e successivamente abbiamo preso il 2° cilindro e abbiamo versato al suo interno 0,5 M di Nitrato di Piombo.
Abbiamo poi versato il contenuto dei cilindri ognuno rispettivamente in un'altra beuta e siamo passati a pesare le 2 beute nella bilancia elettronica, abbiamo ottenuto come peso totale 160,6 g, e abbiamo poi versato il contenuto della 1° Beuta (Ioduro di Potassio) nella 2° Beuta (Nitrato di Piombo), nella quale è avvenuta la reazione chimica è si è ottenuto un precipitato vistoso dal caratteristico colore giallo.
Abbiamo poi effettuato nuovamente la pesata delle due beute, quella contenente il precipitato e quella vuota, e abbiamo notato che il peso dopo la reazione non è cambiato, infatti abbiamo ottenuto come risultato nuovamente 160,6 g.
Conclusione: abbiamo potuto comprender bene il significato della Legge di Lavoisier dimostrandone la proprietà, infatti il peso sia prima che dopo la reazione chimica era identico.
4a ESPERIANZA
Obiettivo: dimostrare sperimentalmente la legge di Proust che dice che quando due o più elementi reagiscono tra loro per formare un composto, essi si combinano secondo un rapporto in peso definito costante
Materiali:
Procedimento: dopo esserci muniti del materiale necessario per effettuare l'esperienza in laboratorio i tecnici, hanno prima pesato 11,25 g sia di ioduro di sodio che di nitrato di piombo, e hanno successivamente preparato nell'aula di chimica 7 becher, al qui interno hanno versato delle dosi decrescenti (35ml, 30ml, 25ml, 20ml, 15ml, 10ml, 5ml) di nitrato di piombo e successivamente hanno aggiunto in ordine crescente delle dosi (5ml, 10ml, 15ml, 20ml, 25ml, 30ml, 35ml) di ioduro di sodio, ottenendo in totale 40 ml delle due soluzioni in ciascun cilindro.
Abbiamo poi aspettato che si stabilizzi il volume del precipitato e abbiamo poi misurato quest'ultimo, infine abbiamo confrontato i dati di ogni cilindro.
1° Cilindro 1 ml 27:10=1:X X=1 10/27 = 0,370
2° Cilindro 3 ml 27:10=3:X X=3 10/27 = 1,11
3° Cilindro 4,5 ml 27:10=4,5:X X=4,5 10/27 = 1,66
4° Cilindro 10 ml 27:10=10:X X=10 10/27 = 3,70
5° Cilindro 4 ml 27:10=4:X X=4 10/27 = 1,48
6° Cilindro 3 ml 27:10=3:X X=3 10/27 = 1,11
7° Cilindro 1,5 ml 27:10=1,5:X X=1,5 10/27 = 0,55
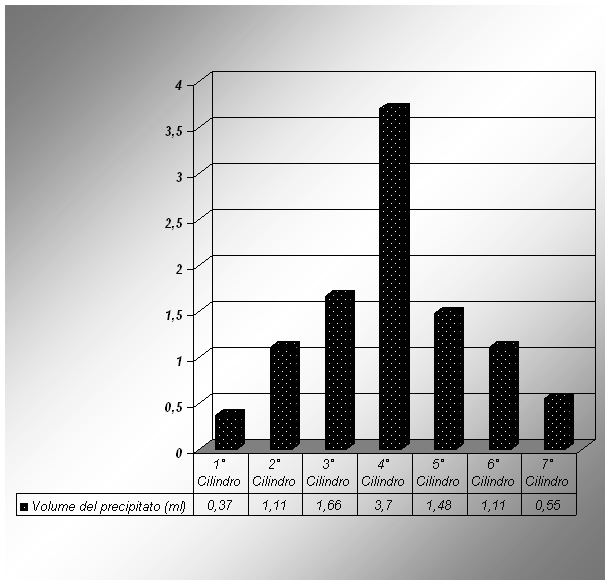
Conclusione: abbiamo potuto capire pienamente la legge di Proust ottenendo un rapporto costante fra i due elementi che hanno reagito insieme.
Considerazioni Finali: queste quattro esperienze sono state entusiasmanti e si sono rivelate molto utili al fine di comprendere un argomento non facile e di avere la possibilità di effettuare delle esperienze in laboratorio.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2026