|
|
| |
Scopo: verificare la prima legge di Faraday.
Materiale: bilancia (± 0,0001g), alimentatore, multimetro, cavi e coccodrilli, fon, becher, matraccio.
Reagenti: rame metallico, soluzione 1M di CuSO4 (solfato di rame).
Procedimento:
Note teoriche:
l'elettrochimica è lo studio delle soluzioni di elettroliti e dei cambiamenti chimici associati con il trasporto di cariche elettriche agli elettrodi immersi in queste soluzioni. Tutte le interazioni chimiche sono di natura elettrica a livello atomico, cosicché, in un certo senso, tutta la chimica è elettrochimica; tuttavia l'elettrochimica delle soluzioni merita un posto particolare in quanto proprio in questa area la chimica fisica si è per la prima volta presentata come una branca a sé stante.
Le migliori sostanze che conducono la corrente elettrica sono i metalli (lo si capisce ricordando le caratteristiche del legame metallico), detti elettrodi di I specie: se sottoposti a una ddp (differenza di potenziale), in essi avviene passaggio di elettroni, che trasportano cariche, ma non materia. Altre sostanze sono gli elettroliti, le cui soluzioni trasportano corrente, con trasferimento anche di materia, mediante gli ioni; sono detti elettrodi di II specie. A questa classe appartengono anche i sali fusi e alcuni liquidi puri (come acido solforico puro e ammoniaca liquida).
 Gli elettroliti forti (sali,
idrossidi alcalini e alcalino-terrosi, che sono ionici anche nello stato solido,
acidi forti, etc.), in soluzione acquosa sono dissociati completamente, o
quasi, in ioni. Gli elettroliti deboli
invece sono poco dissociati (per esempio molti acidi organici). Se in una
soluzione di elettroliti immergiamo due lamine metalliche e ad esse imponiamo
una differenza di potenziale, si
ha passaggio di corrente e, alle due lamine, che si chiamano elettrodi,
avvengono processi chimici.
Gli elettroliti forti (sali,
idrossidi alcalini e alcalino-terrosi, che sono ionici anche nello stato solido,
acidi forti, etc.), in soluzione acquosa sono dissociati completamente, o
quasi, in ioni. Gli elettroliti deboli
invece sono poco dissociati (per esempio molti acidi organici). Se in una
soluzione di elettroliti immergiamo due lamine metalliche e ad esse imponiamo
una differenza di potenziale, si
ha passaggio di corrente e, alle due lamine, che si chiamano elettrodi,
avvengono processi chimici.
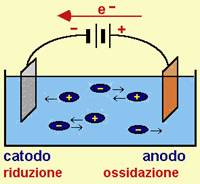
Le reazioni che avvengono sono:
- riduzione (al catodo) Cu++ + 2e- Cu (gli ioni metallici Cu++ si depositano sul catodo)
- ossidazione (all'anodo) Cu Cu++ + 2e-
Il Coulomb (simbolo C), è l'unità di misura della carica elettrica, ed è definita in termini di ampere: 1 Coulomb è la quantità di carica elettrica trasportata da una corrente di 1 ampere che scorre per 1 secondo. 1 Coulomb è all'incirca 6,24×1018 volte la carica di un elettrone.
Ricordando che la
carica elementare è 1,602 x 10-
Le leggi stechiometriche di Faraday sulla elettrolisi sono del 1834:
1. la quantità di elettrolita decomposto durante l'elettrolisi è proporzionale alla quantità totale di elettricità: Q = I·t, in cui I è l'intensità di corrente in amper, t è il tempo per cui essa circola in secondi.
2. la massa di ogni specie chimica trasformata ad ogni elettrodo per il passaggio di 1 Faraday di elettricità è uguale al prodotto della massa molare per il coefficiente di reazione, diviso il numero di elettroni scambiati (è perciò proporzionale alla massa equivalente).
Osservazioni e calcoli:
durante il tempo dell'esperimento (in questo caso 35 minuti) l'intensità di corrente rimane quasi invariata a 58mA, pari a 0,058A.
Ecco le masse dei due elettrodi prima e dopo l'elettrolisi:
|
|
Massa elettr. prima dell'elettrolisi (g) |
Massa elettr. dopo l'elettrolisi (g) |
∆Massa (g) |
|
Anione: |
|
|
|
|
Catione: |
|
|
|
Calcolo la quantità totale di carica elettrica durante l'esperimento:
Q= 0,058A · (35 ·
60)s =
Massa atomica del rame: 63,54 u.m.a.
Ora sapendo che con 1 Faraday metto in movimento una mole di elettroni, nel nostro caso con 1 Faraday metto in movimento mezza mole di Cu++ (visto che ci sono due elettroni in gioco), e con una proporzione calcolo quanto rame ha subito una trasformazione durante l'esperimento:
x=0,040 g di rame coinvolti nella reazione.

Conclusione:
possiamo dire che l'esperimento è riuscito visto che il valore del rame perso dall'anione è simile a quello calcolato teoricamente. Quello del catione non lo consideriamo visto che estraendo l'elettrodo dal becher si sono staccati dei pezzettini di rame, e quindi la massa risulta minore. La prima legge di Faraday risulta dunque verificata.
Svolgimento
dell'esperienza, durante l'elettrolisi
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2026