|
|
| |
![]()
RICHIAMI TEORICI
PASSAGGI DI STATO
Una sostanza può cambiare il proprio stato d'aggregazione attraverso trasformazioni di tipo fisico.
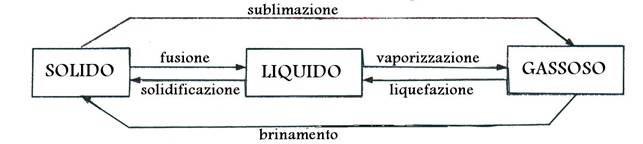
La vaporizzazione avviene solo in superficie (evaporazione) o in tutto il liquido (ebollizione) e riguarda il vapore acqueo.
La liquefazione avviene per raffreddamento di un vapore (condensazione) o di un gas (liquefazione).
MATERIALI USATI
Provetta
Polvere di zolfo
Pinza
Lampada Bunsen
Due capsule di porcellana (di cui una ricoperta con carta d'alluminio)
Beker
Microscopio stereo
Soluzione di solfato rameico pentaidrato
Agitatore
Piccolo frammento di iodio
Imbuto di vetro (dal diametro maggiore della capsula)
PROCEDIMENTO
PARTE PRIMA: fusione e solidificazione.
 Riempita una provetta per circa metà con polvere di
zolfo e tenendola con la pinza, l'abbiamo posta sulla fiamma del bunsen,
movendola attentamente senza rivolgerla verso i compagni.
Riempita una provetta per circa metà con polvere di
zolfo e tenendola con la pinza, l'abbiamo posta sulla fiamma del bunsen,
movendola attentamente senza rivolgerla verso i compagni. 



 OSSERVAZIONI: lo zolfo, fondendo
a 119°C, ha formato un liquido giallo; a mano a mano che la temperatura saliva,
da giallo è diventato arancione e più viscoso, fino a quando, raggiunta la
temperatura d'ebollizione, di 444,6°C, ha assunto un colore nero e ritornando
allo stato liquido. A questo punto, versato nella capsula, lo zolfo si è solidificato
ed ha assunto un aspetto diverso: è tornato giallo; il lento raffreddamento
della parte a contatto con l'aria, ha dato origine a zolfo b
che cristallizza in piccolissimi aghi; la parte a contatto con la carta
stagnola, sulla quale sono brinati i vapori di zolfo prodottisi durante
l'ebollizione, non avendo il tempo di cristallizzare, si è presentata liscia e
levigata. Al microscopio stereo, l'elemento, è parso sottoforma di piccoli
grumi, costituiti dai vari granelli della polvere di zolfo; nello zolfo b
è invece possibile vedere i vari cristalli a forma d'ago ed incolori. La parte
a contatto con la carta d'alluminio, è liscia.
OSSERVAZIONI: lo zolfo, fondendo
a 119°C, ha formato un liquido giallo; a mano a mano che la temperatura saliva,
da giallo è diventato arancione e più viscoso, fino a quando, raggiunta la
temperatura d'ebollizione, di 444,6°C, ha assunto un colore nero e ritornando
allo stato liquido. A questo punto, versato nella capsula, lo zolfo si è solidificato
ed ha assunto un aspetto diverso: è tornato giallo; il lento raffreddamento
della parte a contatto con l'aria, ha dato origine a zolfo b
che cristallizza in piccolissimi aghi; la parte a contatto con la carta
stagnola, sulla quale sono brinati i vapori di zolfo prodottisi durante
l'ebollizione, non avendo il tempo di cristallizzare, si è presentata liscia e
levigata. Al microscopio stereo, l'elemento, è parso sottoforma di piccoli
grumi, costituiti dai vari granelli della polvere di zolfo; nello zolfo b
è invece possibile vedere i vari cristalli a forma d'ago ed incolori. La parte
a contatto con la carta d'alluminio, è liscia.
Dopo breve tempo, con l'aiuto di un agitatore, abbiamo tolto dall'acqua lo zolfo, che ha cambiato totalmente il proprio aspetto.
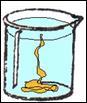 OSSERVAZIONI: lo zolfo,
immediatamente, si è solidificato; il raffreddamento così rapido, ha dato
origine a zolfo g,
dalla forma amorfa, plastica e di color ambra. I vapori di zolfo prodottisi
durante l'ebollizione, sono brinati sulla superficie dell'acqua contenuta nel
beker. Solo dopo qualche giorno lo zolfo g
cambierà nuovamente aspetto trasformandosi in zolfo a,
di colore giallo chiaro e friabile.
OSSERVAZIONI: lo zolfo,
immediatamente, si è solidificato; il raffreddamento così rapido, ha dato
origine a zolfo g,
dalla forma amorfa, plastica e di color ambra. I vapori di zolfo prodottisi
durante l'ebollizione, sono brinati sulla superficie dell'acqua contenuta nel
beker. Solo dopo qualche giorno lo zolfo g
cambierà nuovamente aspetto trasformandosi in zolfo a,
di colore giallo chiaro e friabile.
PARTE SECONDA: vaporizzazione e condensazione del solvente con cristallizzazione del soluto.
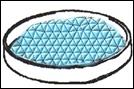

 OSSERVAZIONI: il vapore acqueo,
venendo a contatto con le pareti fredde del beker, si è condensato, dando
origine a tante piccole gocce. Nella capsula, a vaporizzazione ultimata, è
rimasta una polvere grigia: si tratta del soluto, cioè del sale solfato
rameico, che non avendone avuto il tempo non ha formato i cristalli.
Aggiungendo dell'acqua distillata alla polverina, questa torna di colore
azzurro (è una caratteristica di questo sale: con l'acqua è azzurro, senza, è
grigia). Il cambio di colore è la dimostrazione che l'acqua contenuta nella
soluzione è evaporata con il calore. Al microscopio stereo, la sostanza dataci
come campione, presenta cristalli dalla forma irregolare e di colore azzurro
per la presenza d'acqua; la sostanza prodotta industrialmente da noi, invece,
non è cristallizzata e perciò presenta minuscoli granelli di colore grigio,
perché è priva d'acqua.
OSSERVAZIONI: il vapore acqueo,
venendo a contatto con le pareti fredde del beker, si è condensato, dando
origine a tante piccole gocce. Nella capsula, a vaporizzazione ultimata, è
rimasta una polvere grigia: si tratta del soluto, cioè del sale solfato
rameico, che non avendone avuto il tempo non ha formato i cristalli.
Aggiungendo dell'acqua distillata alla polverina, questa torna di colore
azzurro (è una caratteristica di questo sale: con l'acqua è azzurro, senza, è
grigia). Il cambio di colore è la dimostrazione che l'acqua contenuta nella
soluzione è evaporata con il calore. Al microscopio stereo, la sostanza dataci
come campione, presenta cristalli dalla forma irregolare e di colore azzurro
per la presenza d'acqua; la sostanza prodotta industrialmente da noi, invece,
non è cristallizzata e perciò presenta minuscoli granelli di colore grigio,
perché è priva d'acqua.
PARTE TERZA: sublimazione e sbrinamento
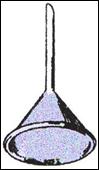
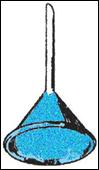
OSSERVAZIONI: dopo qualche istante, i vapori di iodio, di colore violetto, hanno cominciato a risalire lungo le pareti dell'imbuto, dove si sono brinati, formando minuscoli cristalli aghiformi di colore blu. Nella capsula, non è rimasto nulla, perché lo iodio è sublimato: è passato dallo stato solido a quello gassoso.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025