|
|
| |
Proprietà Periodiche
q Introduzione
q Richiamo alla Tavola Periodica
q Proprietà periodiche
q Dimensioni atomiche e ioniche
q Energia di Ionizzazione
q Affinità Elettronica
q Elettronegatività
Proprietà Periodiche
Le proprietà chimiche e fisiche d 252e45c egli elementi sono state alla base della costruzione della Tavola Periodica (Mendeleev funzione nel peso atomico). Trovano oggi una corretta interpretazione sulla base della teoria della configurazione elettronica esterna e presentano andamento periodico

La configurazione elettronica esterna è data da gli elettroni che occupano lo strato elettronico più esterno, caratterizzato da il valore maggiore di n (numero quantico principale)
Nella Tavola Periodica gli elementi sono stati ordinati:
Per numero atomico (Z) crescente in orizzontale
Le righe sono dette PERIODI
Nella colonna (GRUPPO gli elementi presentano un uguale configurazione elettronica esterna ( n)

![]()
![]() Le proprietà fisiche e chimiche degli elementi dipendono principalmente
dalla loro struttura elettronica esterna
Le proprietà fisiche e chimiche degli elementi dipendono principalmente
dalla loro struttura elettronica esterna
Hanno un andamento che si ripete lungo le righe
Gli elementi di uno stesso gruppo hanno simili proprietà
Proprietà Periodiche
Analisi delle principali proprietà periodiche lungo i periodi e lungo i gruppi
Principali proprietà periodiche
Dimensioni atomiche e ioniche
Energia di ionizzazione
Affinità elettronica
Elettronegatività

FDimensioni atomiche e ioniche (pm)
Motivazione: solo gli elettroni degli strati più interni schermano gli elettroni esterni dal nucleo
Energia di ionizzazione
E' l'energia che occorre per allontanare un elettrone da un atomo isolato e portarlo a distanza infinita.
Energia di prima ionizzazione

A(g) A(g)+ + e- kJ . mol-1
A(g)+ A(g)2+ + e- Energia di seconda ionizzazione
A(g)2+ A(g)3+ + e- Energia di terza ionizzazione
E Ia ion. < E IIa ion. < E IIIa ion.
Aumenta lungo il periodo e diminuisce lungo un gruppo
| | 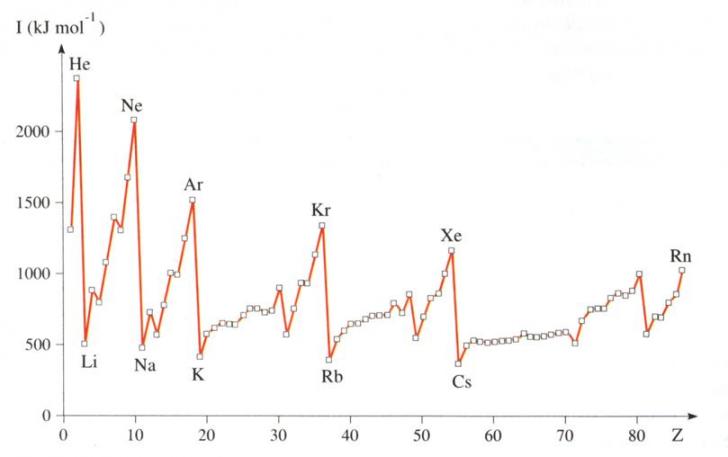 |
Affinità Elettronica
![]()
![]()
E' l'energia che si libera nel processo d'addizione di un elettrone ad un atomo isolato

A(g) + e- A(g)- kJ . mol-1
Energia > 0 si libera energia A- stabile
L'affinità elettronica è una misura della stabilità dello ione A- o della tendenza di A a catturare un elettrone
Gli alogeni hanno la maggior affinità elettronica nel periodo, che diminuisce scendendo nel gruppo
Affinità Elettronica |
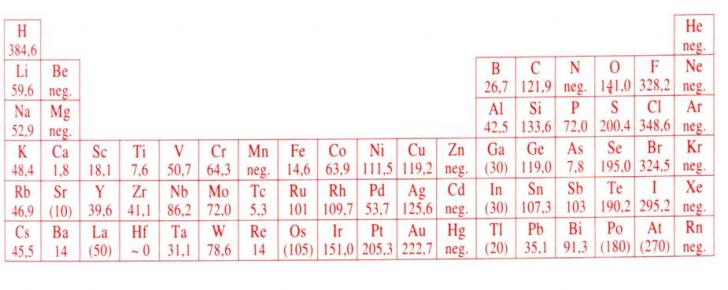
Elettronegatività
E' la tendenza di un atomo in una molecola di attrarre verso di sé la coppia di elettroni di legame.
L'elettronegatività non è una grandezza che si misura sperimentalmente, ma può essere ricavata dalla sua definizione.

c = 1/2(I + A)
Aumenta lungo il periodo con un massimo per gli alogeni e diminuisce lungo il gruppo
Il Fluoro è l'elemento più elettronegativo
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2026