|
|
| |
Preparazione del composito NiO - SiO2 al 25% in peso
mediante metodologia SOL - GEL a parite da
Preparazione del composito CuO -
SiO2 al 25% in peso mediante metodologia SOL - GEL a partire da
Scopo dell'esperienza:
Lo scopo di questa esperienza è la preparazione di due composti mediante la tecnologia sol-gel.
Materiale preparato:
I materiali ottenuti a fine esperienza sono
composti appartenenti alla famiglia dei nanocomposti. Sono tali quei composti 525h74f
in cui almeno una delle fasi è di dimensioni nanometriche, ovvero dell'ordine
di 10-
Cenni teorici:
La tecnica utilizzata per l'esecuzione di questa esperienza è l'applicazione della tecnologia sol-gel. Il termine sol-gel è usato per descrivere la preparazione di materiali ceramici in qualsiasi forma che incomincia da una sospensione colloidale di particelle solide in un liquido, il sol, e si trasforma in un gel attraverso un processo di idrolisi e polimerizzazione. Processi di essiccamento e trattamenti termici trasformeranno il gel in un ossido ceramico. Il processo Sol - Gel è orientato sopratutto ad attività di sintesi di ossidi ceramici sia in forma di film sottile che massiva. La tecnica sol - gel è interessante ed innovativa perché consente di preparare, a temperature relativamente basse o a temperatura ambiente, materiali a base di ossidi inorganici con buone caratteristiche di durezza, resistenza chimica, porosità e resistenza termica. Il processo sol - gel parte dall'idrolisi dell'alcossido, la formazione di una sospensione colloidale e l'evoluzione di quest'ultima verso un gel in un processo di condensazione. I precursori così definiti ( gli alcossidi ) sono molto reattivi perché presentano gruppi OR i quali essendo altamente elettronegativi, rendono il metallo pronto all'attacco nucleofilo. Il primo passo della reazione sol - gel è l'idrolisi del precursore, tale reazione può avvenire sia in ambiente acido che in ambiente basico. L'idrolisi avviene per attacco nucleofilo dell'acqua all'atomo di silicio. Poiché l'idrolisi in ambiente neutro è molto lenta, si fa avvenire la reazione in catalisi acida o basica cioè usando acidi o basi come catalizzatori. Dato che l'acqua è un reagente, il rapporto molare H2O/alcossido influenza la velocità di idrolisi. Bisogna tener conto che alcossidi come il tetraetilortosilicato ( TEOS ) che è stato utilizzato nell'esperienza, non sono solubili in acqua, ed è necessaria l'aggiunta di un solvente come per esempio l'etanolo. Infatti per solubilizzare alcossidi polari, ( TEOS ), si utilizza un solvente polare. Analizziamo i meccanismi che regolano la catalisi acida che e quello che è stato adottato nel corso dell'esperienza: nel primo stadio di idrolisi un atomo di ossigeno del gruppo alcossido viene protonato, il silicio diventa elettrofilo e quindi più ricettivo di attacco nucleofilo da parte dell'acqua. Il meccanismo di reazione prevede la formazione di un intermedio a cinque termini ed è di tipo SN2.
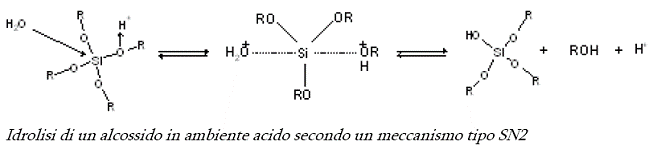
La velocità di idrolisi viene aumentata da sostituenti con scarso ingombro sterico. Lea reazione di idrolisi catalizzata da basi procede con velocità minore rispetto all'idrolisi acida anche se la concentrazione anche se la concentrazione del catalizzatore è uguale, perché la sostituzione del primo alcossido procede molto lentamente, mentre i passi successivi sono più veloci all'aumentare del numero di gruppi sostituiti sul monomero. Anche per l'idrolisi catalizzata da basi è stato proposto un meccanismo di tipo SN2. La reazione di condensazione parte dai gruppi silanolo Si - OH che si sono formati nel processo di idrolisi i quali danno polimerizzazione con conseguente formazione di legami Si - O . Sostanzialmente la reazione la reazione di condensazione può avvenire secondo due meccanismi: attacco di un gruppo silanolo su un atomo di silicio e successiva espulsione di una molecola di acqua ed attacco con eliminazione di una molecola di alcool nel caso di un monomero parzialmente idrolizzato. La velocità minima di condensazione si ha per un pH 1.5 - 2. le reazioni che portano alla formazione del gel, non si fermano in corrispondenza di questo punto ma proseguono secondo un processo di invecchiamento( aging ) che determina poi le caratteristiche finali del gel in base al tempo di invecchiamento. Infatti è durante questa fase che si verificano i processi di riorganizzazione strutturale. Durante la condensazione si ha quindi una soluzione colloidale la cui viscosità aumenta nel tempo a causa della crescita delle catene polimeriche e quando il gel avrà raggiunto una determinatà caratteristica di viscosità o di elasticità si può determinare tale punto come tempo di gel, Tgel. Il processo finale della reazione sol - gel è l'essiccamento, si divide in diversi stadi. Inizialmente il gel subisce una diminuzione di volume proporzionale alla quantità di liquido evaporato. Ad un certo punto, detto punto critico, le particelle sono impaccate per questo motivo non è più possibile il movimento interno delle particelle, infatti questa fase è critica perché è più probabile che avvengano fratture. All'interno rimane ancora del liquido, e l'evaporizazione continua ad avvenire per diffusione verso l'esterno. Le caratteristiche peculiari dei prodotti ottenuti con tecnologia sol - gel sono:
elevata omogeneità su scala molecolare;
prodotti di altissima purezza perché si pare da materie purissime;
possibilità di evitare altissime temperature con notevole risparmio energetico;
possibilità di ottenere direttamente films sottili per rivestimento o fibre;
d'altra parte però esistono anche degli svantaggi:
alto costo delle materie prime pure;
elevata diminuzione del volume finale conseguente difficoltà di ottenere prodotti monoliti;
porosità finale;
lunghi tempi di processo;
pericolo di tossicità per gli operatori.
Parte sperimentale:
Composto NiO - SiO2 al 25% in peso a
partire da
Reattivi
Si(OC2H5)4 (TEOS) PM =
Ni( NO3)2 6H2O PF = 290.79 g/mol
C2H5OH ( etanolo ) PM =46.07 g/mol d= 0.81 g/mL Titolo 95%
HNO3 conc.
SiO2 PF = 60.09 g/mol
Ni PA = 58..71 g/mol
O PA = 16 g/ mol
VETRERIA E SRTUMENTAZIONE:
Buretta da 25 mL
1 pipetta di Pausteur
1 cilindro graduato da 25 mL
1 agitatore magnetico
1 barretta magnetica ( ancoretta )
1 pallone ad un collo da 100 o 250 mL
1 beaker di teflon
Forno a muffola
1 capsula di teflon
1 capsula di porcellana
Bilancia termica
pH-metro o cartina tornasole
1 mortaio di porcellana
La preparazione si basa sulle seguenti reazioni:
![]()
![]() IDROLISI Si (OC2H5)4 + 4 H2O Si
(OH)4 + 4C2H5OH
IDROLISI Si (OC2H5)4 + 4 H2O Si
(OH)4 + 4C2H5OH
![]()
![]() CONDENSAZIONE Si (OH)4 SiO2 + 2H2O
CONDENSAZIONE Si (OH)4 SiO2 + 2H2O
Nel corso del trattamento termico avvengono i seguenti processi:
a) eliminazione della fase liquida comprese le molecole di acqua;
b) decomposizione del nitrato secondo la reazione:
![]() Ni(NO3)2
NiO + 2NO2
+ ½ O2
Ni(NO3)2
NiO + 2NO2
+ ½ O2
Si ottiene pertanto una dispersione di nanoparticelle di ossido di nichel in una matrice di SiO2
CALCOLI
Come possiamo vedere dalla reazione di decomposizione del nitrito si ha :
moli di Ni( NO3 )2 = ![]()
moli Ni( NO3 )2 = moli NiO
g NiO = moli Ni(NO3)2 x PF NiO = 0.0137moli x 74.71 g/moli =
Ci calcoliamo ora i g di SiO2 , considerando che il composito che dobbiamo preparare è al 25% in peso, per cui si ha:
g NiO = 25%
g SiO2 = 75%
25 : 75 = g NiO : g SiO2
75 * g NiO 75 * 1.0235
g SiO2 = ------ = ------ =
25 25
g SiO2 3.0708g
moli SiO2 = ---- = ----- = 0.0511 moli
P.F. SiO2 60.09g/moli
Dalle reazioni possiamo vedere che :
moli Si ( OH )4 = moli SiO2 = moli Si(OC2H5)4
Per cui i g di Si(OC2H5)4 saranno dati da :
g Si(OC2H5)4 = moli SiO2 * P.M. Si(OC2H5)4
g Si(OC2H5)4 = 0.0511 moli * 208.33 g/mol =
Siccome abbiamo a che fare con un liquido ( soluzione acquosa) al 98 %
, dobbiamo determinare il peso del liquido che contiene
---- * 100 =
98
Conosciamo la densità del Si(OC2H5)4 , ovvero il TEOS, quindi possiamo determinare i ml da prelevare :
d= 0.934 g/l
10.8628g
ml TEOS = ---- = 11.6 ml errore buretta : ± 0.05 ml
0.934 g/l
errore cilindro : 0.250 ml
PROCEDIMENTO
Pesare i grammi richiesti di sale di nichel direttamente in un pallone da 100 o 250 mL;
Servendosi del cilindro graduato misurare 20 mL di etanolo e versarli nel pallone, quindi aggiungere 15 gocce di HNO3 concentrato con la pipetta di Pasteur (15 gocce ), mettere in agitazione fino a completa dissoluzione del sale;
Servendosi della buretta, preventivamente avvinata prima con etanolo e poi con il TEOS, misurare i mL di TEOS richiesti e sgocciolarli nel beaker di teflon;
Con il cilindro graduato misurare 20 mL di etanolo e versali nel beaker contenente il TEOS;
Versare il contenuto del beaker nel pallone contenente la soluzione di nickel, agitare e controllare il pH che deve essere < 1 se risultasse maggiore, aggiungere qualche goccia di HNO3 conc. Fino a far rientrare il valor nel limite richiesto;
Mettere la barretta magnetica ( ancoretta ) dentro il pallone e servendosi dell'agitatore magnetico agitare il contenuto del pallone per un'ora;
Travasare il contenuto del pallone in una capsula di teflon e lasciare in assoluto riposo coperto da un foglio di carta da filtro bucherellato. La gelazione avverrà nell'arco di circa 3-5 giorni ed il contenuto della capsula avrà assunto la consistenza di un solido elastico;
A gelazione avvenuta macinare i pezzetti di materiale in un mortaio. Trasferire una porzione di polvere nella capsula di porcellana;
Sottoporre
la polvere ad un trattamento termico nella muffola a
Registrare lo spettro di diffrazione di raggi X per controllare lo stato strutturale del materiale ottenuto.
Calcolo della resa
Errore bilancia :
g teorici = g NiO + g SiO2 = ( 1.0235 + 3.0708) =
g Ni ( NO3 )2 pesati =
Dopo la gelazione :
g gel =
g gel macinato =
g gel macinato 8.2829
resa % su perdita dopo macinazione = ------- * 100 = ----- * 100 = 91.0 %
g gel 9.1497
Dopo trattamento termico:
g
gel dopo tratt.termico =
g Ni ( NO3 )2 pesati 4.0106
resa % su quantità pesata = ---------- * 100 = ---- * 100 =85.0 %
g gel dopo tratt.termico 4.7175
moli di Ni( NO3
)2 = ![]()
0.0138 moli di Ni( NO3 )2 = moli NiO
g NiO = moli Ni( NO3
)2 x PM NiO = 0.0138 x 74.71
=
g NiO = 25%
g SiO2 = 75%
25 : 75 = g NiO : g SiO2
75 * g NiO 75 * 1.0309
g SiO2 = ------ = ------ = 3.0928g
25 25
g teorici = ( g SiO2 + g NiO) = 3.0928 + 1.0309 = 4.1237g
g teorici 4.1237
resa % sul teorico = --------- * 100 = --------* 100 = 87.5 %
g gel dopo tratt.termico 4.7175
Preparazione del composito CuO-SiO2
al 25% in peso mediante metodologia sol-gel a partire da
Reattivi
Si(OC2H5)4 ( TEOS ) P.M.= 208.33 g/mol d= 0.934 g/l titolo 98 %
Cu ( NO3 )2 2.5 H2O P.F.= 232.55 g/mol
C2H5OH ( etanolo ) P.M. = 46.07 g/mol d= 0.81 g/l titolo 95 %
HNO3 conc.
SiO2 P.F.= 60.09 g/mol
Cu P.A.= 63.55 g/mol
O P.A. = 16 g/mol
Vetreria e strumentazione
La preparazione del composito si basa sulle seguenti reazioni:
![]()
![]() Idrolisi Si(OC2H5)4 + H2O Si ( OH )4 + C2H5OH
Idrolisi Si(OC2H5)4 + H2O Si ( OH )4 + C2H5OH
![]()
![]() Condensazione Si ( OH )4 SiO2 + 2 H2O
Condensazione Si ( OH )4 SiO2 + 2 H2O
Durante il trattamento termico, avvengono l'eliminazione della fase liquida comprese le molecole d'acqua e la decomposizione del nitrato secondo la reazione :
Δ
![]() Cu ( NO3 )2 CuO
+ 2 NO2 + ½ O2
Cu ( NO3 )2 CuO
+ 2 NO2 + ½ O2
Si ottiene pertanto una dispersione di nanoparticelle di ossido di rame in una matrice di SiO2 .
Calcoli
Come possiamo vedere dalla reazione di decomposizione del nitrito si ha :
moli Cu ( NO3 )2 = moli CuO
g Cu ( NO3 )2
moli Cu ( NO3 )2 = ------ = ------- = 0.01720 moli
P.F. Cu ( NO3 )2 232.55 g/mol
g CuO = moli Cu ( NO3 )2 * P.F. CuO = 0.01720 * (63.55+16) =
Ci calcoliamo ora i g di SiO2 , considerando che il composito che dobbiamo preparare è al 25% in peso, per cui si ha:
g CuO = 25%
g SiO2 = 75%
25 : 75 = g CuO : g SiO2
75 * g CuO 75 * 1.36826
g SiO2 = ------ = ------ =
25 25
g SiO2 4.10478
moli SiO2 = ---- = ----- = 0.0683 moli
P.F. SiO2 60.09
Dalle reazioni possiamo vedere che :
moli Si ( OH )4 = moli SiO2 = moli Si(OC2H5)4
Per cui i g di Si(OC2H5)4 saranno dati da :
g Si(OC2H5)4 = moli SiO2 * P.M. Si(OC2H5)4
g Si(OC2H5)4 = 0.0683 moli * 208.33 g/mol =
Siccome abbiamo a che fare con un liquido ( soluzione acquosa) al 98 %
, dobbiamo determinare il peso del liquido che contiene
---- * 100 =
98
Conosciamo la densità del Si(OC2H5)4 , ovvero il TEOS, quindi possiamo determinare i ml da prelevare :
d= 0.934 g/l
14.519g
ml TEOS = ---- = 15.5 ml errore buretta : ± 0.05 ml
0.934 g/l
errore cilindro : 0.250 ml
Procedimento
Si pesano i g di Cu ( NO3 )2 direttamente in un pallone da 250 ml.
Servendoci di un cilindro graduato, misuriamo 20 ml di etanolo e li versiamo nel pallone, quindi aggiungiamo 15 gocce di HNO3 concentrato con la pipetta di Pasteur.
A questo punto mettiamo in agitazione fino a completa dissoluzione del sale.
Nel frattempo avviniamo la buretta prima con etanolo poi con TEOS, misuriamo i ml di TEOS richiesti e li sgoccioliamo nel becker di teflon.
Con il cilindro misuriamo 20 ml di etanolo e li versiamo nel becher contenente il TEOS.
Versiamo il tutto nel pallone contenente la nostra soluzione , agitiamo e verifichiamo con una cartina torna sole che il pH della nostra soluzione sia < 1.
Mettiamo l'ancoretta nel pallone e lasciamo la nostra soluzione in agitazione per un ora.
Travasiamo il tutto in una capsula di teflon e lasciamo riposare coperto da un foglio di carta da filtro bucherellato.La gelazione avverrà nell'arco di 3-5 giorni ed il contenuto della capsula avrà una consistenza di un solido elastico.
A gelazione avvenuta, maciniamo il gel e lo pesiamo.
La polvere ottenuta
la sottoponiamo a trattamento termico nella muffola a
Calcolo della resa
Errore bilancia :
g teorici = g CuO + g SiO2 = ( 1.36826 + 4.10478 ) =
g Cu ( NO3 )2 pesati =
Dopo la gelazione :
g gel =
g gel macinato =
g gel macinato 10.0185
resa % su perdita dopo macinazione = ------- * 100 = ----- * 100 = 97.5 %
g gel 10.2759
Dopo trattamento termico:
g
gel dopo tratt.termico =
g Cu ( NO3 )2 pesati 4.0416
resa % su quantità pesata = ---------- * 100 = ---- * 100 = 72.0 %
g gel dopo tratt.termico 5.6092
g teorici 5.47304
resa % sul teorico = --------- * 100 = --------* 100 = 97.6 %
g gel dopo tratt.termico 5.6092
![]()
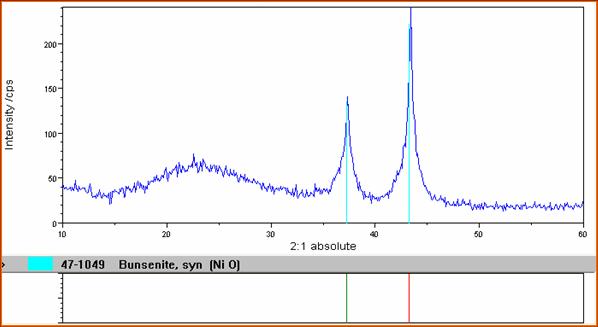

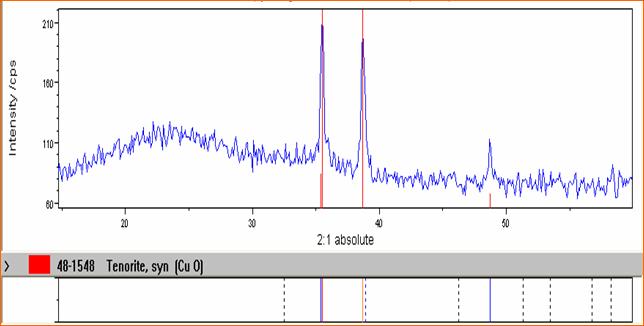
Commenti sullo spettro
SOL - GEL NiO - SiO2 SOL - GEL CuO - SiO2
Dall'analisi del campione effettuata al diffrattometro a raggi X ricaviamo informazioni riguardo al nostro prodotto. Ad una banda caratteristica di un amorfo come SiO2 che presenta un banda caratteristica intorno a 22, si sovrappongono dei picchi dovuti alla presenza degli ossidi del metallo presenti i quali si trovano nella fase dispersa nella matrice di silice. Si vede chiaramente come dei cristalli di CuO( picchi alti e stretti ) si trovano diffusi in una matrice di silicio. Osserviamo la stessa cosa nel caso dell' NiO.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2026