|
|
| |
Legame Covalente |
Si forma attraverso la compartecipazione di coppie di elettroni 858h75i da parte di due atomi A, e B uguali o diversi.
Caratteristiche principali :
Direzionalità (interessa l'asse
internucleare).
Energia di legame (quantità di
energia necessaria a rompere il
legame in fase gassosa).
Lunghezza di legame
(distanza media fra i due nuclei).
Ordine di legame
Legame Covalente |
F Si forma attraverso la compartecipazione di
coppie di elettroni 858h75i da parte di due atomi A e
B uguali o diversi
Energia di Legame |
|
LEGAME |
LUNGHEZZA (pm) |
ENERGIA (kJ mol-1) |
ORDINE |
|
C-C |
|
|
|
|
C=C |
|
|
|
|
C=C |
|
|
|
|
N-N |
|
|
|
|
N=N |
|
|
|
|
N=N |
|
|
|
|
H-H |
|
|
|
|
F-F |
|
|
|
|
Cl-Cl |
|
|
|
|
I-I |
|
|
|
|
H-F |
|
|
|
|
H-I |
|
|
|
|
H2O |
|
|
|
|
NH3 |
|
|
|
|
CH4 |
|
|
|
N.B. Mentre le energie di legame fra coppie di atomi differenti variano molto, l'energia di uno stesso legame rimane sostanzialmente la stessa in molecole diverse.
Legame Covalente |
Due metodi approssimati per la descrizione quantomeccanica del legame covalente.
Metodo del legame di valenza (VB)
uno o più doppietti di elettroni
localizzati fra i nuclei
Y Ya Yb
Metodo dell'orbitale Molecolare
(MO)
Si costruiscono orbitali molecolari
policentrici (estesi a tutta la molecola)
Y Ya ± lYb
L C A O Linear Combination of Atomic
Orbital
Legame Covalente |
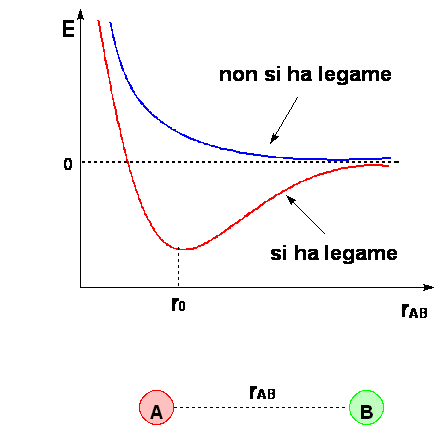
Legame di tipo s ha simmetria di rotazione cilindrica rispetto all'asse internucleare, la densità elettronica è concentrata tra i due nuclei, è il primo che si instaura,
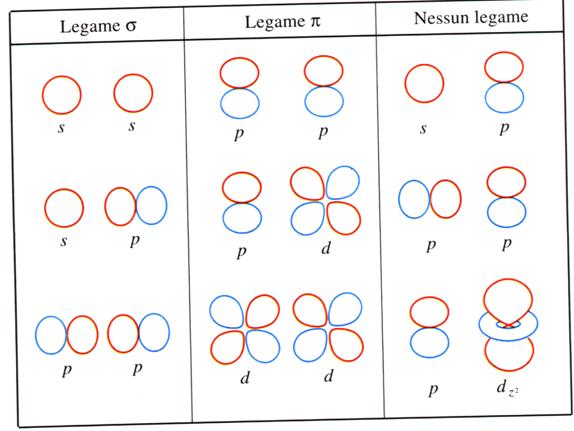 Legame di tipo p hanno densità elettronica nulla
lungo l'asse internucleare
Legame di tipo p hanno densità elettronica nulla
lungo l'asse internucleare
(MO)
Si presuppone di costruire delle Y (funzioni d'onda) come fatto per l'atomo, quel che si ricava sono orbitali molecolari policentrici (estesi a tutta la molecola)
![]()
F si combinano linearmente gli orbitali atomici dello strato di valenza
L C A O. Linear Combination of Atomic Orbital
Y Ya ± lYb
F combinando n AO si ottengono n MO
Molecola di H2 (MO)
Molecola di H2 (MO)
Diagramma livelli Energetici (MO)
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025