|
|
| |
Effettuare la reazione di idrolisi basica, o saponificazione, di una miscela di trigliceridi.
 Materiale:
Materiale:Becker da 150ml,
Attrezzatura per il bagnomaria,
Bacchetta di vetro,
Provetta,
Attrezzatura per la filtrazione,
Cartina Tornasole.
Introdurre in un becker da 150ml 20ml di olio e altri 20ml di idrossido di sodio 5M. Scaldare a bagnomaria per circa mezzora, mescolando di tanto in tanto. Durante il ris 525i85f caldamento ripristinare l'acqua evaporata con acqua distillata calda. Dopo mezzora dovremmo osservare che la miscela reagente si addensa. Prelevare con la bacchetta di vetro una piccola quantità di composto e lo poniamo in una provetta e andiamo ad aggiungere un po' di acqua distillata calda. Se si notano delle goccioline di grasso in superficie la saponificazione non è terminata, continuiamo a scaldare. Nel caso non si formino delle bollicine introdurre nel becker 60ml di acqua distillata calda, mescolare il contenuto fino ad ottenere un miscuglio pastoso. Aggiungere circa 15g di cloruro di sodio [eso facilita la saponificazione]. Continuare a mescolare fino a separare il sapone dallo stato liquido. Togliere il becker dal bagnomaria e filtrare. Rimettere il sapone a bagnomaria e aggiungere 100ml di acqua distillata calda e altri 10g di cloruro di sodio. Mescolare il contenuto e verificare il pH. Se< il pH è molto basico continuare a lavare il sapone finchè non arriva alla neutralità. A questo punto filtrare di nuovo e depositare il risultato della filtrazione in un contenitore per dare al sapone la forma desiderata.
La reazione
avvenuta è: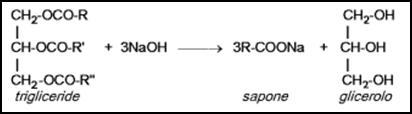
Il sapone è generalmente un sale di sodio o di potassio di un acido carbossilico alifatico a lunga catena; viene prodotto e usato per sciogliere le sostanze grasse nei processi di pulizia.
Si prepara per saponificazione, ovvero per idrolisi alcalina, di grassi di origine animale o vegetale.
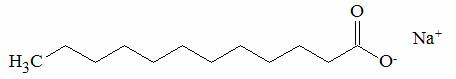
esempio di struttura di un sapone
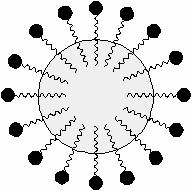 Numerosi saponi sono dei tensioattivi. Per via della sua struttura,
la molecola del sapone ha una testa idrofila ionizzata
negativamente ed una coda idrofoba. Le molecole di sapone sono pertanto in
grado di emulsionare le sostanze grasse,
consentendone l'allontanamento con l'acqua.
Numerosi saponi sono dei tensioattivi. Per via della sua struttura,
la molecola del sapone ha una testa idrofila ionizzata
negativamente ed una coda idrofoba. Le molecole di sapone sono pertanto in
grado di emulsionare le sostanze grasse,
consentendone l'allontanamento con l'acqua.
Le code delle molecole di sapone si sciolgono nella massa della sostanza grassa, che viene circondata formando una micella. Dato che tutte le teste delle molecole di sapone recano una carica negativa, la repulsione elettrostatica impedisce alle micelle di ri-aggregarsi e le mantiene in sospensione nell'acqua.
La saponificazione è l'idrolisi di un estere in condizioni basiche e provoca la formazione di un alcool e del sale dell'acido corrispondente.
I saponi sono di solito sali di sodio di acidi carbossilici a lunga catena; vengono prodotti e usati per sciogliere le sostanze grasse nei processi di pulizia.
Il termine saponificazione è comunemente utilizzato in riferimento alla reazione di un idrossido di un metallo alcalino (base) con un grasso o un olio che dà origine al sapone.
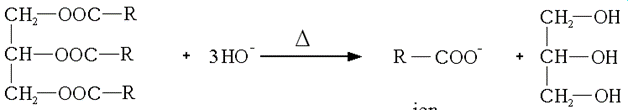
Viene aggiunto cloruro di sodio per facilitare la precipitazione del sapone.
| R1 | C=O | O | R2 |
Gli esteri sono composti organici prodotti dalla reazione di acilazione di un alcol o di un fenolo con acido carbossilico o un suo derivato. La molecola degli esteri ha questa struttura caratteristica:
dove R1 e R2 sono le restanti parti della molecola.
Vengono denominati esteri anche i prodotti dell'acilazione degli alcoli con altri acidi inorganici, che danno origine alla famiglia degli esteri inorganici, che hanno proprietà chimiche molto simili agli esteri organici ma la cui struttura caratteristica è leggermente diversa da questa. La nomenclatura degli esteri segue quella dei sali degli acidi reagenti, quindi avremo, per esempio:
Gli esteri a basso peso molecolare hanno odore gradevole, fruttato; gli altri invece sono inodori. Esteri naturali di elevato peso molecolare sono i grassi e le cere, le quali sono formate da grassi superiori e da alcoli monovalenti a catena lunga.
Dal punto di vista biologico, gli esteri possono essere suddivisi in tre classi a seconda della lunghezza della catena di atomi di carbonio e del tipo di alcool e di acido.
Sono gli esteri più piccoli, in cui sia l'acido e l'alcol hanno una catena di meno di 10 atomi
di carbonio; sono molto comuni nelle essenze di frutta, naturali e artificiali. Per
esempio:
CH3COOC2H5 acetato di etile (pera, mela, ribes e frutti di bosco).
CH3COOC5H11 acetato di amile (ananas, pera).
C4H9COOC2H5 isovalerianato di etile (pesca, valeriana).
Nelle cere le catene di carbonio, sia nell'acido che nell'alcol, sono più lunghe di 10 atomi
(a volte più di 30): a volte sono di pari lunghezza. Alcuni classificano le cere nel gruppo
dei lipidi semplici, insieme agli oli naturali e ai grassi.
C15H31COOC16H33 palmitato di cetile (nel bianco di balena o spermaceti).
C15H31COOC31H63 palmitato di miricile (cera d'api).
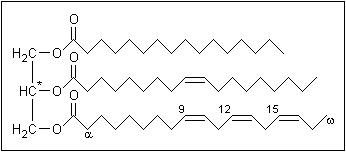 Sono senz'altro la classe di esteri più importante dal punto di vista
biologico. L'alcol è sempre lo stesso, la glicerina
(detta anche propanolo o propantriolo), un alcol trivalente. Gli acidi che
reagiscono con la glicerina sono tutti a catena lunga (da 12 a 20 atomi di
carbonio nell'uomo), monoinsaturi o polinsaturi, e monocarbossilici, cioè con
un solo gruppo acido carbossile. Quindi si possono avere esteri monogliceridi,
digliceridi o trigliceridi (nell'immagine sopra: Esempio
di un trigliceride insaturo. Parte sinistra: glicerolo,
parte destra dall'alto al basso: acido
palmitico, acido oleico, acido alfa-linoleico, formula chimica: C55H98O6)
a seconda di quanti gruppi ossidrili della glicerina vengono sostituiti (uno,
due o tutti e tre). I componenti più noti dei gliceridi sono l'acido
palmitico, l'acido stearico e l'acido oleico.
Sono senz'altro la classe di esteri più importante dal punto di vista
biologico. L'alcol è sempre lo stesso, la glicerina
(detta anche propanolo o propantriolo), un alcol trivalente. Gli acidi che
reagiscono con la glicerina sono tutti a catena lunga (da 12 a 20 atomi di
carbonio nell'uomo), monoinsaturi o polinsaturi, e monocarbossilici, cioè con
un solo gruppo acido carbossile. Quindi si possono avere esteri monogliceridi,
digliceridi o trigliceridi (nell'immagine sopra: Esempio
di un trigliceride insaturo. Parte sinistra: glicerolo,
parte destra dall'alto al basso: acido
palmitico, acido oleico, acido alfa-linoleico, formula chimica: C55H98O6)
a seconda di quanti gruppi ossidrili della glicerina vengono sostituiti (uno,
due o tutti e tre). I componenti più noti dei gliceridi sono l'acido
palmitico, l'acido stearico e l'acido oleico.
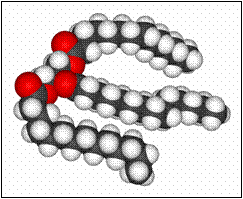 I monogliceridi e i digliceridi possono essere otticamente attivi, se
le loro molecole sono asimmetriche; gli 1,2-digliceridi sono
interessanti biologicamente perché sono precursori chimici dei trigliceridi e
dei fosfolipidi.
Ma di gran lunga più importanti sono i trigliceridi,
che costituiscono il gruppo più numeroso di lipidi semplici, cioè di quelle
sostanze non solubili in acqua ma solubili nei solventi apolari.
I monogliceridi e i digliceridi possono essere otticamente attivi, se
le loro molecole sono asimmetriche; gli 1,2-digliceridi sono
interessanti biologicamente perché sono precursori chimici dei trigliceridi e
dei fosfolipidi.
Ma di gran lunga più importanti sono i trigliceridi,
che costituiscono il gruppo più numeroso di lipidi semplici, cioè di quelle
sostanze non solubili in acqua ma solubili nei solventi apolari.
Tigliceride in 3d
 Azione importante dell'olio di oliva è quello per la prevenzione delle
malattie cardiovascolari.
Azione importante dell'olio di oliva è quello per la prevenzione delle
malattie cardiovascolari.
Nel nostro organismo infatti ci sono 2 tipi di colesterolo: l'HDL (il
"colesterolo buono" vero e proprio spazzino delle arterie, che rimuove il
colesterolo dalle pareti delle arterie e lo riporta al fegato dove contribuisce
alla formazione della bile, la cui funzione, nella digestione, è proprio quella
di emulsionare i grassi) ad alta densità di lipoproteine, e LDL (il
"colesterolo cattivo") a bassa intensità.
Gli ac. grassi polinsaturi riducono sia il colesterolo
LDL che HDL, sono altamente instabili, si ossidano velocemente formando
radicali liberi pericolosi per l'organismo umano. Gli ac. grassi monoinsaturi,
abbondanti nell'olio d'oliva, riducono l'LDL ma non l'HDL, e resistono meglio
all'ossidazione.
Una dieta ricca di olio d'oliva aiuta a mantenere bassi i livelli di LDL, ,
mentre non diminuisce i livelli di HDL, protetto dagli acidi grassi
monoinsaturi di cui è ricco l'olio d'oliva, e così si può prevenire le malattie
cardiovascolari, l'arteriosclerosi, l'infarto del miocardio, evitando
l'accumulo dei grassi nelle pareti delle arterie.
L'olio è un buon ingrediente di cottura che
serve per condire tutti i tipi di alimenti (carne, pesce,...): è un ottimo
condimento per le insalate, e ingrediente di base per la maionese.
L'olio di oliva, grazie alla presenza di acidi grassi meno instabili di quelli
presenti negli oli di semi, è ideale per le fritture, poiché la sua temperatura
critica è nettamente superiore alla temperatura abituale di frittura degli
alimenti. Tutti gli oli a temperatura elevata e in presenza di ossigeno
atmosferico subiscono un'accelerazione del fenomeno di ossidazione, tanto più
accentuato quanto maggiore il grado di insaturazione, mentre risulta ritardato
dalla presenza di sostanze antiossidanti. Gli ac.
grassi polinsaturi in queste condizioni sono altamente instabili, si
ossidano velocemente formando radicali liberi o polimerizzando; tra tutti gli
oli solo quello d'oliva, ricco soprattutto di monoinsaturi (più stabili) e di
sostanze antiossidanti, reagisce meglio all'attacco combinato dell'ossigeno e
delle alte temperature.
I fattori principali da cui dipendono le
alterazioni dei grassi in fase di cottura sono 2:
-il livello della temperatura;
-la durata del tempo di cottura;
il primo si basa sul fatto che ogni grasso ha un suo punto di tolleranza,
chiamato punto di fumo o temperatura critica, dopo il quale il glicerolo
contenuto negli acidi grassi si decompone in acroleina, sostanza molto dannosa
(p.es. per il fegato). L'olio d'oliva ha uno dei punti di fumo più alti tra gli
oli, fino a circa 220°C. Il secondo fattore, che è ancora più importante,si
basa sul fatto che i primi cambiamenti avvengono a temperature non molto
elevate; se mantenute costanti, per un tempo prolungato, queste temperature
possono produrre sostanze con effetti tossici. Perciò si può trarre la
conclusione che l'olio d'oliva si presta meglio alla frittura rispetto agli
altri oli.
Siamo riusciti nel nostro intento, abbiamo prodotto un sapone!!
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025