|
|
| |
I Gas
Il gas ideale
Lo studio dello stato gassoso si basa sul modello di gas ideale, che presenta queste cinque caratteristiche:
![]()
![]()
![]()
![]()
![]() Le particelle non hanno interazioni attrattive o repulsive tra di esse
e con le pareti del recipiente.
Le particelle non hanno interazioni attrattive o repulsive tra di esse
e con le pareti del recipiente.
![]() Le particelle si muovono di moto rettilineo uniforme in direzioni
casuali.
Le particelle si muovono di moto rettilineo uniforme in direzioni
casuali.
Gli urti tra particella e particella e tra particelle e pareti del recipiente sono totalmente elastici.
![]() Il volume complessivo delle particell 737b12h e (chiamato covolume) è
trascurabile rispetto al volume totale che esse occupano.
Il volume complessivo delle particell 737b12h e (chiamato covolume) è
trascurabile rispetto al volume totale che esse occupano.
Grandezze fisiche che caratterizzano un gas
Le tre grandezze fisiche necessarie per descrivere un gas sono il volume (V), la pressione (P) e la temperatura (T).
Volume: è il volume occupato dal gas. Nel SI[*] si misura in m3 (metri cubi). Il volume può essere misurato anche in litri (l) o millilitri (ml)
Pressione: rappresenta la totalità degli urti che avvengono nell'unità di tempo tra le particelle di gas e le pareti del recipiente. Nel SI si misura in Pa (pascal). La pressione può essere misurata anche in bar, torr (o millimetri di mercurio) ed atmosfere (atm).
1 atm = 101325 Pa = 1,013 bar = 760 torr
Temperatura: rappresenta l'energia cinetica media delle particelle di gas, è quindi collegata alla loro velocità media. Nel SI di misura in K (kelvin). Per trasformare la temperatura da gradi centigradi (°C) a kelvin (K) basta sommare 273,16.
T(K) = T(°C) + 273,16
Leggi semplici dei gas
Le leggi semplici dei gas sono quattro e derivano da osservazioni sperimentali. Esse prendono in esame in che modo varia una delle tre grandezze fisiche V, P, T al variare delle altre due.
1) Legge di Boyle
"A temperatura costante, il volume e la pressione di un gas sono grandezze inversamente proporzionali"
Significa che, mantenendo costante la temperatura, aumentando la pressione di un gas, il suo volume diminuisce nello stesso modo (se si raddoppia la pressione, il volume del gas dimezza).
Tcostante Tcostante
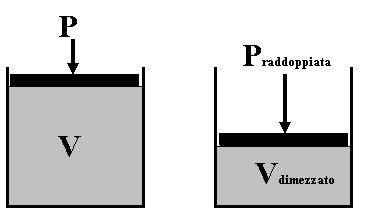
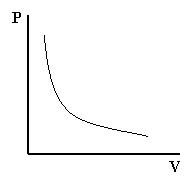
Matematicamente il prodotto tra la pressione ed il volume è costante, il che è rappresentabile come una iperbole su un grafico P/V.
Legge di Boyle: P .V = costante (a temperatura costante)
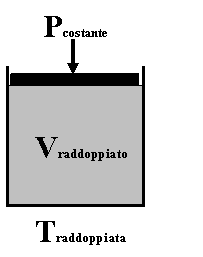
2) Legge di Charles
"A pressione costante, la temperatura e il volume di un gas sono grandezze direttamente proporzionali"
Significa che, mantenendo costante la pressione, aumentando la temperatura di un gas, il suo volume aumenta nello stesso modo (se si raddoppia la temperatura, il volume del gas raddoppia).
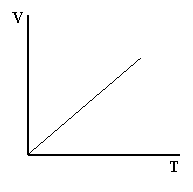
Matematicamente il rapporto tra il volume e la temperatura di un gas è costante, il che è rappresentabile come una retta su un grafico V/T.
V
T
![]() Legge di Charles: = costante (a pressione costante)
Legge di Charles: = costante (a pressione costante)


3) Legge di Gay-Lussac
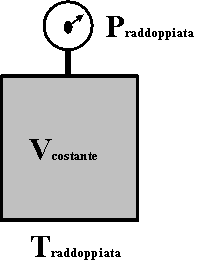
"A volume costante, la temperatura e la pressione di un gas sono grandezze direttamente proporzionali"
Significa che, mantenendo costante il volume del recipiente, aumentando la temperatura di un gas, la sua pressione aumenta nello stesso modo (se si raddoppia la temperatura, la pressione del gas raddoppia).
T
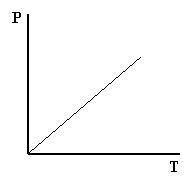
Matematicamente il rapporto tra la pressione e la temperatura di un gas è costante, il che è rappresentabile come una retta su un grafico P/T.
P
T
![]() Legge di Gay-Lussac: = costante (a volume costante)
Legge di Gay-Lussac: = costante (a volume costante)
4) Principio di Avogadro
"Nelle stesse condizioni di temperatura e pressione, volumi uguali di diversi gas contengono lo stesso numero di particelle"
Significa che, fissate la temperatura e la pressione (ad esempio 300 K
e 1,2 atm) un dato volume di gas (ad esempio
Equazione di stato dei gas ideali
La famosa equazione di stato dei gas perfetti (o ideali) è una espressione matematica che lega tra di esse le tre grandezze fisiche V, P, T. Tutti i gas, purchè possano essere considerati ideali, soddisfano questa equazione:
P . V = n . R . T
Grandezza Unita di misura
P pressione atm Pa
V volume l m3
n numero di moli mol mol
R costante dei gas 0,0821 l.atm.mol-1.K-1 8,314 j.mol-1.K-1
T temperatura K K
NB: è necessario conoscere a memoria i due valori di R, nei due sistemi di unità di misura.
Esempio:
Quale è il volume occupato da
Il problema si risolve ricavando l'espressione del volume dall'equazione di stato dei gas:
n.R.T
P
![]() V =
V =
Trovare il numero di moli di azoto (formula chimica: N2, peso molecolare: PM = 28)
g
|
Trasformare la temperatura in K:
Sostituire nell'espressione del volume:
|
n.R.T |
|
Questo gas occupa
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025