|
|
| |
Formule di Struttura
Carica Formale: è data dalla differenza fra il numero di elettroni nell'atomo libero e quello attribuitogli formalmete nella formula di struttura
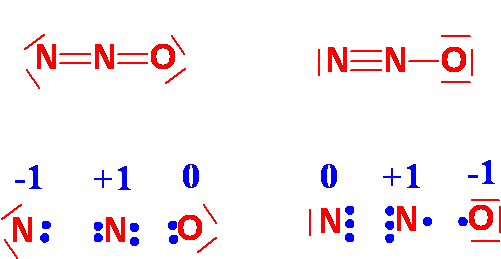
La formula limite più stabile è quella in cui vi è la minore separazione di cariche formali e/o la carica negativa/positiva è sull'atomo più/meno elettronegativo (minor energia)
Risonanza
Spesso è possibile scrivere più formule di struttura per una stessa molecola o ione, tali formule sono dette formule limite
La descrizione della struttura molecolare avviene mediante un ibrido di risonanza di formule limite
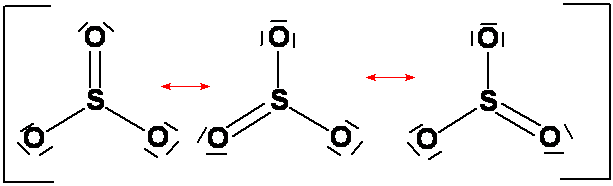
La formula a minor energia fra le varie formule limite è quella che più contribuisce alla descrizione reale della molecola
La molecola reale ha energia minore dell'energia della singola formula limite
Risonanza
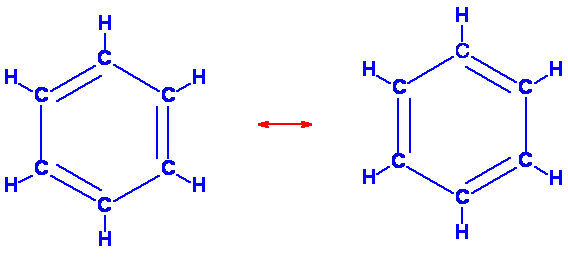
I doppi legami (legame p) non sono localizzati
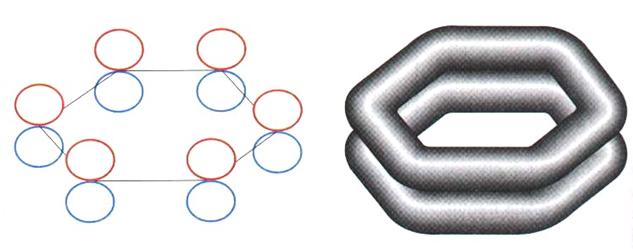
ogni orbitale p interagisce con i due orbitali p adiacenti
Formule di Struttura
Le formule di struttura elettronica permettono di determinare la geometria della molecola e l'ordine di legame esistente tra gli atomi
Teoria della repulsione delle coppie elettroniche dello stato di valenza (VSEPR)
F La disposizione geometrica dei legami intorno a un atomo, in una molecola, dipende dal numero totale di coppie di elettroni nello strato di valenza dell'atomo, comprese sia le coppie di legame che quelle non condivise (di non-legame).
F Le coppie di elettroni in uno strato di valenza adottano la disposizione che rende massimo l'angolo tra le coppie (minima repulsione).
Teoria della repulsione delle coppie elettroniche dello stato di valenza (VSEPR)
Le coppie di legame e di non legame si dispongono come le cariche dello stesso segno sulla superficie sferica di un conduttore
Coppie |
Disposizione |
Figura |
Angolo |
|
|
|
|
|
|
|
lineare |
|
|
|
|
triangolare |
|
|
|
|
tetraedrica |
|
|
|
|
bipiramidale trigonale |
|
|
|
|
ottaedrica |
|
|
Formule di Struttura
F Sommare gli elettroni degli strati esterni e le eventuali cariche, se ione poliatomico e dividere per due (n° coppie elettroniche)
F Legare all'atomo centrale (in genere il meno elettronegativo) tutti gli altri con un legame semplice
F Disporre le coppie elettroniche su gli atomi periferici seguendo la regola dell'ottetto. Disporre le rimanenti coppie sull'atomo centrale.
(Valutazione geometria della molecola con VSEPR e tipo di orbitali ibridi utilizzati dagli atomi)
F Distribuzione delle coppie elettroniche per avere formule limite accettabili secondo il metodo delle cariche formali
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025