|
|
| |
DETERMINAZIONE DELLA CMC DI UN TENSIOATTIVO MEDIANTE MISURE DI CONDUCIBILITÁ
Introduzione teorica
I tensioattivi sono molecole composte da una testa polare idrofila e una coda idrocarburica idrofoba (anfifilici). La particolare caratteristica di questi composti è, come dice il nome stesso, la capacità di operare sulla tensione superficiale di un liquido, la quale corrisponde all'energia in esubero che possiedono le molecole del solvente nell'interfase per carenza di legame con le altre molecole. Il tensioattivo viene adsorbito positivamente nell'interfase diminuendo così la tensione superficiale del liquido rimediando alla carenza di legame; questo adsorbimento è possibile grazie alla catena idrocarburica del tensioattivo che si ripartisce bene nell'interfase,che è meno polare della fase massiva (o bulk). In ogni caso il tensioattivo si ripartisce molto be 858g61i ne in entrambe le fasi: nel bulk grazie alla testa polare, mentre nell'interfase grazie alla catena idrocarburica.
Al crescere della concentrazione si aggiungono ai fenomeni di adsorbimento, sopra descritti, fenomeni di autoassociazione tra le molecole di tensioattivo causate dalle interazioni coda-coda che prevalgono sulle repulsioni tra le teste; ciò porta alla formazione di grossi aggregati di tensioattivo: le micelle.
La concentrazione alla quale inizia la micellizzazione è detta concentrazione critica di micellizzazione (CMC): al di sotto di questo valore prevalgono fenomeni di adsorbimento, in cui i tensioattivi tendono a ripartirsi nelle due fasi (bulk e interfase) e le repulsioni tra le teste sono molto più forti delle interazioni coda-coda. Al di sopra della CMC prevalgono fenomeni di autoassociazione con conseguente formazione di micelle. Il valore della CMC varia dal tipo del tensioattivo e dalle caratteristiche del solvente (a causa della diversa solvatazione).
La formazione di sistemi micellari comporta una netta variazione delle proprietà chimico-fisiche del sistema stesso. Monitorando l'andamento di determinati parametri in funzione della concentrazione del tensioattivo in soluzione, è possibile determinare il valore della CMC del tensioattivo utilizzato in quel solvente.
Nelle esperienze qui sotto descritte viene monitorato l'andamento della conducibilità specifica c in funzione della concentrazione del tensioattivo.
Svolgimento
Nel corso di due giornate vengono effettuate quattro esperienze riguardanti tre tensioattivi diversi: Dodecil Solfato (SDS), Dodecilpiridinio Cloruro Monoidrato (DPC) e il Cetilpiridinio Cloruro Monoidrato (CPC).

In ogni caso sono state utilizzate due soluzioni
di partenza del tensioattivo a diversa molarità, la più concentrata,
Per prima cosa si predispone il contenitore di
misura (50 cm3) con l'ancoretta e lo si posa sull'agitatore magnetico,
bloccandolo tramite una pinza e collegandolo, quindi, al sistema termostatico;
si fa circolare acqua a circa
La soluzione viene lasciata costantemente sotto agitazione e quando il valore segnato dal conduttimetro è stabile si legge e, quindi, segna la conducibilità. Si aggiunge immediatamente una seconda quantità di tensioattivo e si procede come prima.
Nelle due esperienze circa
Le misure dell'SDS in soluzione acquosa e mista e del DPC sono state caratterizzate da buona stabilità fin dalle concentrazioni più basse, invece le misure circa il CPC hanno avuto inizialmente, soprattutto, e durante tutto il corso dei rilevamenti poca stabilità.
Una volta terminate le misure si mettono in grafico le concentrazioni contro la conducibilità e si traggono, quindi, le relative conclusioni circa il valore di CMC.
Calcoli
Preparazione soluzione di
partenza 1 10-
Ctensioattivi =
1*10-
PMDPC = 283,45 g/mol PMSDS = 288.38 g/mol PMCPC= 333,45 g/mol
![]()
![]()
![]()
![]()
Dai calcoli emerge che per la preparazione di 50 cm3 di soluzione madre, avremmo dovuto pesare dai 1.42 mg per il DPC ai 1.66 mg del CPC.
Pesare una quantità così bassa di tensioattivo avrebbe portato a grossi errori circa l'effettiva massa utilizzata e quindi anche sulla molarità esatta della nostra soluzione madre. Pertanto abbiamo proceduto in tutti e tre i casi per diluizione dalla soluzione 0.05M.
Preparazione soluzione di
partenza 1 10-
Csoluz.madre=0.05 M Csoluz.finale=1*10-
![]()
![]()
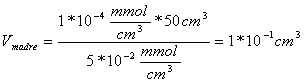
Quindi
per la preparazione della soluzione madre abbiamo prelevato con una
micropipetta (da
Formula per il calcolo delle concentrazioni.
![]()
Tramite questa formula abbiamo formulato una serie di aggiunte delle due soluzioni, prima la più diluita, poi la più concentrata, da effettuare.
Per entrambe le esperienze della SDS abbiamo
compiuto diciotto aggiunte di
Per quanto riguarda
In tutti e quattro i casi abbiamo così raggiunto
una concentrazione prossima a 6 10-2 che, in
ogni caso, ci ha permesso di riconoscere
Raccolta dati, grafici relativi e determinazione della CMC
SDS (in H2O)
|
V (cm3) |
mmoliTENS |
cTENS (mol/dm3) |
c mS |
|
|
|
|
|
1,000E-04 |
|
|
|
|
|
|
2,988E-04 |
|
|
|
|
|
|
4,960E-04 |
|
|
|
|
|
|
6,917E-04 |
|
|
|
|
|
|
8,858E-04 |
|
|
soluzione
iniziale 1x10- |
|
|
|
1,078E-03 |
|
|
soluzione |
|
|
|
1,270E-03 |
|
|
soluzione |
|
|
|
1,459E-03 |
|
|
|
|
|
|
1,647E-03 |
|
|
|
|
|
|
1,834E-03 |
|
|
|
|
|
|
2,019E-03 |
|
|
|
|
|
|
2,203E-03 |
|
|
|
|
|
|
2,385E-03 |
|
|
|
|
|
|
2,567E-03 |
|
|
|
|
|
|
2,746E-03 |
|
|
|
|
|
|
2,925E-03 |
|
|
|
|
|
|
3,102E-03 |
|
|
|
|
|
|
3,277E-03 |
|
|
|
|
|
|
3,711E-03 |
|
|
|
|
|
|
8,272E-03 |
|
|
|
|
|
|
1,275E-02 |
|
|
|
|
|
|
1,715E-02 |
|
|
|
|
|
|
2,232E-02 |
|
|
|
|
|
|
3,070E-02 |
|
|
|
|
|
|
3,879E-02 |
|
|
|
|
|
|
4,661E-02 |
|
|
|
Il valore della CMC è dato dall'ascissa del punto d'intersezione delle due rette, determinato risolvendo il seguente sistema:
![]()
Risolvendo il sistema col metodo di Cramer si trova che il valore della CMC è il seguente:
![]()
![]()
![]()
SDS (in H2O/isopropanolo 70:30)
|
V (cm3) |
mmoliTENS |
CTENS(mol/dm3) |
c mS |
|
|
|
|
|
1,00E-04 |
|
|
soluzione
iniziale 1x10- |
|
|
|
2,99E-04 |
|
|
soluzione |
|
|
|
4,96E-04 |
|
|
soluzione |
|
|
|
6,92E-04 |
|
|
|
|
|
|
8,86E-04 |
|
|
|
|
|
|
1,08E-03 |
|
|
|
|
|
|
1,27E-03 |
|
|
|
|
|
|
1,46E-03 |
|
|
|
|
|
|
1,65E-03 |
|
|
|
|
|
|
1,83E-03 |
|
|
|
|
|
|
2,02E-03 |
|
|
|
|
|
|
2,20E-03 |
|
|
|
|
|
|
2,39E-03 |
|
|
|
|
|
|
2,57E-03 |
|
|
|
|
|
|
2,75E-03 |
|
|
|
|
|
|
2,92E-03 |
|
|
|
|
|
|
3,10E-03 |
|
|
|
|
|
|
3,28E-03 |
|
|
|
|
|
|
3,71E-03 |
|
|
|
|
|
|
8,27E-03 |
|
|
|
|
|
|
1,28E-02 |
|
|
|
|
|
|
1,71E-02 |
|
|
|
|
|
|
2,23E-02 |
|
|
|
|
|
|
3,07E-02 |
|
|
|
|
|
|
3,88E-02 |
|
|
|
|
|
|
4,66E-02 |
|
|
|
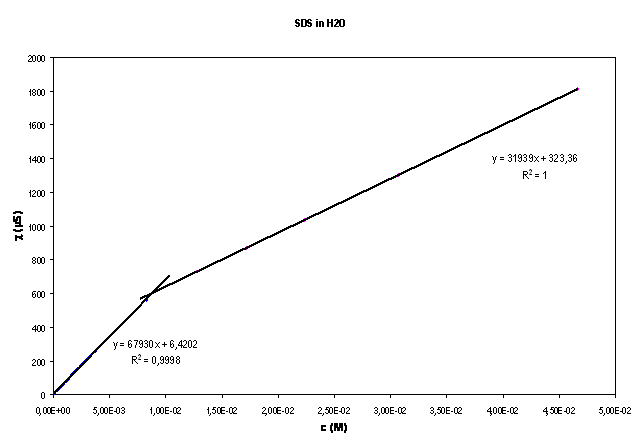
Il valore della CMC è dato dall'ascissa del punto d'intersezione delle due rette, determinato risolvendo il seguente sistema:
![]()
Risolvendo il sistema col metodo di Cramer si trova che il valore della CMC è il seguente:
![]()
![]()
![]()
DPC
|
V(cm3) |
mmoliTENS |
CTENS (mol/dm3) |
c mS |
|
|
|
|
|
1,00E-04 |
|
|
soluzione
iniziale 1x10- |
|
|
|
2,99E-04 |
|
|
soluzione |
|
|
|
4,96E-04 |
|
|
soluzione |
|
|
|
6,92E-04 |
|
|
|
|
|
|
8,86E-04 |
|
|
|
|
|
|
1,08E-03 |
|
|
|
|
|
|
1,27E-03 |
|
|
|
|
|
|
1,46E-03 |
|
|
|
|
|
|
1,65E-03 |
|
|
|
|
|
|
1,83E-03 |
|
|
|
|
|
|
2,02E-03 |
|
|
|
|
|
|
2,20E-03 |
|
|
|
|
|
|
2,39E-03 |
|
|
|
|
|
|
2,57E-03 |
|
|
|
|
|
|
4,45E-03 |
|
|
|
|
|
|
6,32E-03 |
|
|
|
|
|
|
8,18E-03 |
|
|
|
|
|
|
1,00E-02 |
|
|
|
|
|
|
1,46E-02 |
|
|
|
|
|
|
1,90E-02 |
|
|
|
|
|
|
2,34E-02 |
|
|
|
|
|
|
2,77E-02 |
|
|
|
|
|
|
3,28E-02 |
|
|
|
|
|
|
4,10E-02 |
|
|
|
|
|
|
4,89E-02 |
|
|
|
|
|
|
5,65E-02 |
|
|
|
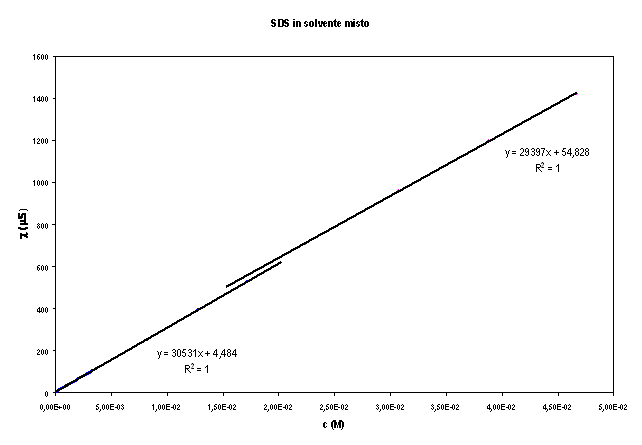
Il valore della CMC è dato dall'ascissa del punto d'intersezione delle due rette, determinato risolvendo il seguente sistema:
![]()
Risolvendo il sistema col metodo di Cramer si trova che il valore della CMC è il seguente:
![]()
![]()
![]()
CPC
|
V(cm3) |
mmoliTENS |
CTENS (mol/dm3) |
c mS |
|
|
|
|
|
1,00E-04 |
|
|
soluzione
iniziale 1x10- |
|
|
|
1,50E-04 |
|
|
soluzione |
|
|
|
2,00E-04 |
|
|
soluzione |
|
|
|
2,49E-04 |
|
|
|
|
|
|
2,99E-04 |
|
|
|
|
|
|
3,48E-04 |
|
|
|
|
|
|
3,98E-04 |
|
|
|
|
|
|
4,47E-04 |
|
|
|
|
|
|
4,96E-04 |
|
|
|
|
|
|
5,45E-04 |
|
|
|
|
|
|
5,94E-04 |
|
|
|
|
|
|
6,43E-04 |
|
|
|
|
|
|
6,92E-04 |
|
|
|
|
|
|
7,40E-04 |
|
|
|
|
|
|
7,89E-04 |
|
|
|
|
|
|
8,37E-04 |
|
|
|
|
|
|
5,71E-03 |
|
|
|
|
|
|
1,05E-02 |
|
|
|
|
|
|
1,52E-02 |
|
|
|
|
|
|
1,98E-02 |
|
|
|
|
|
|
2,43E-02 |
|
|
|
|
|
|
2,87E-02 |
|
|
|
|
|
|
3,30E-02 |
|
|
|
|
|
|
3,73E-02 |
|
|
|
|
|
|
4,15E-02 |
|
|
|
|
|
|
4,56E-02 |
|
|
|
|
|
|
4,96E-02 |
|
|
|
|
|
|
5,36E-02 |
|
|
|
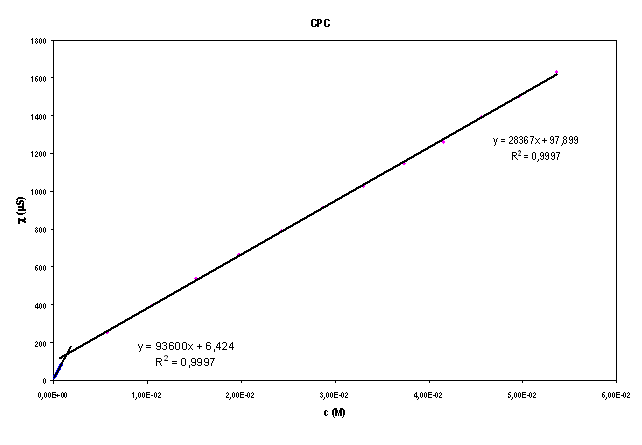
Il valore della CMC è dato dall'ascissa del punto d'intersezione delle due rette, determinato risolvendo il seguente sistema:
![]()
Risolvendo il sistema col metodo di Cramer si trova che il valore della CMC è il seguente:
![]()
![]()
![]()
CONCLUSIONI TEORICHE
La conducibilità specifica c può essere determinata dalla seguente formula matematica:
c= F z n a c (u+ + u
dove F è la costante di Faraday, z è la carica dei singoli ioni, n è il numero dei singoli ioni, a il grado di dissociazione dell'elettrolita, c la concentrazione, u+ e u- sono rispettivamente la mobilità del catione e dell'anione in soluzione.
Dai grafici sopra riportati, ad eccezione dell'SDS in solvente misto, si nota che la pendenza della retta al di sopra della CMC è minore rispetto a quella al di sotto di tale valore; ciò sta ad indicare che per una stessa variazione di concentrazione di tensioattivo, la variazione di conducibilità specifica della soluzione è minore per il sistema micellare che per il tensioattivo libero. La formazione delle micelle infatti comporta una diminuzione di cariche libere rispetto a quelle che sarebbero presenti nel tensioattivo libero a quella data concentrazione, con la conseguente diminuzione del valore di z. Questo è dovuto al fatto che il controione viene assorbito sulle teste polari delle micelle e non può più partecipare al fenomeno di conduzione.
Si potrebbe considerare come contributo alla variazione di pendenza della retta al di sopra della CMC anche la variazione della mobilità che si ha passando dal tensioattivo libero al sistema macellare, che risulta, comunque, irrilevante rispetto a quella del valore di z.
Come scritto nell'introduzione teorica, il valore di CMC varia dal tipo di tensioattivo utilizzato e anche dalle caratteristiche del solvente in cui si trova.
Consideriamo come varia il valore della CMC dell'SDS utilizzando prima come solvente acqua e poi una soluzione H2O/isopropanolo 70:30.
La solvatazione del tensioattivo da parte del solvente riveste un ruolo determinante per il valore della CMC. L'SDS (vedi formula di struttura nello svolgimento) ha come testa polare un gruppo solfato, quest'ultima viene facilmente solvatata dall'acqua grazie alle interazioni elettrostatiche che si instaurano tra le molecole creando un guscio di solvatazione che ne scherma la carica e diminuisce la repulsione tra le teste. La coda, invece, dato il suo carattere apolare, è difficilmente solvatata da un solvente polare, per questo motivo l'acqua non impedisce l'instaurarsi di interazioni coda-coda e la conseguente formazione di micelle.
Utilizzando come solvente la soluzione di acqua/isopropanolo le teste polari dell'SDS vengono solvatate come nel caso precedente, l'unica differenza è la formazione di un guscio di solvatazione di dimensioni maggiori,che causa un maggior ingombro sterico tra le teste e rende più difficoltosa la formazione delle micelle. La coda idrocarburica, invece, viene meglio solvatata in solvente misto dato che la parte alchilica dell'alcol riesce a instaurare interazioni con essa. La parziale solvatazione delle catene idrocarburiche rende più difficoltoso il crearsi di interazioni tra le code, causando una più difficile formazione di micelle. Da queste considerazioni si evince che il valore della CMC dell'SDS in acqua deve essere minore di quello in solvente misto.
Dai dati raccolti si è ottenuto che
Il valore della CMC dell'SDS in solvente misto è
però molto maggiore di quello reale (1*10-
Il diverso comportamento dell'SDS come elettrolita nei due solventi è dovuto alla diversa polarità di questi. In solventi molto polari, come l'acqua, è favorita la dissociazione del sale che si comporta come elettrolita forte ( =1), causando una forte pendenza prima della CMC. In solventi meno polari, come la soluzione di isopropanolo, la dissociazione del sale è difficoltosa, ne consegue che l'SDS si comporta da elettrolita debole, causando una minor pendenza della retta prima della CMC.
Per diversi tensioattivi nello stesso solvente, il valore della CMC dipende dalle caratteristiche della testa e della coda dei composti.
I tensioattivi CPC e DPC hanno stessa testa
polare ma differente catena idrocarburica, in particolare
I tensioattivi DPC e SDS hanno invece stessa catena idrocarburica ma differente testa polare, in particolare quella del DPC è molto più ingombrante stericamente rispetto a quella dell'SDS. Nella trattazione del valore della CMC non si considerano le interazioni tra le code in quanto identiche, ma vengono solo prese in esame le interazioni tra le teste. In particolare nella formazione delle micelle tra le teste del DPC si ha un ingombro sterico maggiore che causa una difficoltà di impaccamento tra i monomeri, mentre per l'SDS l'ingombro sterico delle teste è minore quindi la formazione di micelle sarà favorita (avviene a concentrazioni minori) per l'SDS. Ci si aspetta dai valori sperimentali che CMCSDS<CMCDPC. I valori sperimentali corrispondono alle previsioni fatte.
Dalle esperienze svolte si deduce che la formazione di micelle è favorita (CMC minore) per tensioattivi a catena idrocarburica lunga e testa poco ingombrante, e per solventi che non impediscono le interazioni tra le code.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025