|
|
| |
Composti di Coordinazione
Sono quei composti in cui uno atomo centrale, forma un numero di legami (s) maggiore del suo numero d'ossidazione. Per antonomasia l'atomo centrale è uno ione metallico.
Tali composti sono detti anche complessi
Gli atomi con cui vengono formati i legami si dicono "ATOMI DONATORI" (O, N, P, F, Cl, ..)
Le molecole o gli ioni a cui appartengono gli atomi donat 939c25j ori si dicono "LEGANTI"
NUMERO DI COORDINAZIONE: è il numero di atomi legati all'atomo centrale. I numeri di coordinazione più comuni sono e
Leganti con un solo atomo donatore si dicono monodentati, con più atomi donatori polidentati
Composti di Coordinazione
Esempi :
F [M(H2O)6]2+, [M(NH3)6]2+; M=Fe2+, Co2+, Ni2+, Cu2+, Zn2+..
F [SiF6]2-, [BF4]-
F Clorofille (Mg2+; Emoglobine, citocromi (Fe2+/Fe3+); Vitamina B12 (Co+/Co2+); Anidrasi carbonica (Zn2+); etc.
F Agenti di contrasto (Gd3+), farmaci anticancro (Pt2+)
F Colorazione del vetro, catalizzatori industriali, complessometria (EDTA), elettro-deposizione metalli,
C. di Coordinazione NOMENCLATURA
Le regole principali:
1) Si nomina prima l'anione, poi il catione.
2) Si scrive in successione il nome del: atomo centrale, leganti anionici, leganti neutri. Si racchiude fra parentesi quadre la formula del complesso
Nel caso di più leganti dello stesso tipo si usano i prefissi di-, tri-, tetra-, penta-, esa-; per i leganti più complicati: bis-, tris-, tetrakis-
4) I nomi dei leganti anionici vengono modificati aggiungendo il suffisso -o (Cl- cloro, OH- idrosso, CN- ciano). I leganti neutri non hanno nomi sistematici (H2O acquo, NH3 ammino, CO carbonile)
5) Il numero d'ossidazione del metallo viene indicato da un numero romano tra parentesi il nome del metallo. Se il complesso è un anione si aggiunge il suffisso -ato
C. di Coord. Esempi Nomenclatura
[Cr(NH3)4Cl2]Cl : cloruro di
diclorotetraamminocromo(III)
Cr(H2O)5Cl]Cl : cloruro di
cloropentaacquocromo(II)
Co(NH3)4(NO2)Cl]NO3 : nitrato di
cloronitrotetraamminocobalto(III)
Ni(NH3)6](ClO4)2 : perclorato di esaamminonichel(II)
Ni(NH3)6]2+ : ione esaamminonichel(II)
K[Pt(NH3)Cl3] : tricloroamminoplatinato(II) di potassio
Pt(NH3)2Cl2] : diclorodiamminoplatino(II)
Ni(CO)4] : nichel tetracarbonile
K4[Fe(CN)6] : esacianoferrato(II) di potassio
(ferrocianuro di potassio)
Co(en)3]Cl3 : cloruro di tris(etilendiammino)
cobalto(III)
C. di Coord. Esempi di Leganti
Leganti monodentati : F-, Cl-, Br-,
CN-, H2O, NH3, NO3-, CO, NO, -COO-.
Leganti polidentati: SCN-, en, EDTA,
acac-
Leganti chelati: leganti polidentati in grado di legare due o più atomi donatori allo stesso atomo centrale.
|
|
Composti di Coordinazione
Numero di Coordinazione
|
n° coordinazione |
geometria |
esempi |
|
|
lineare |
[Ag(NH3)2]+, [Cu(CN)2]- |
|
|
triangolare |
[CuCl3]- |
|
|
tetraedrica |
[MX4]2-; M=Zn2+, Co2+; X=Cl-, Br- |
|
|
quadrata |
[Pt(NH3)4]2+ |
|
|
bipiramidale |
Fe(CO)5 |
|
|
ottaedrica |
[M(H2O)6]2+, [M(NH3)6]2+, [Fe(CN)6]4- |
Teoria del Campo Cristallino
Tratta le interazioni fra lo ione metallico o atomo centrale e gli atomi donatori come se fossero di natura puramente elettrostatica.
L'effetto del campo elettrico dei leganti sui 5 orbitali d degeneri dello ione è quello di rimuovere la degenerazione e di scinderli in funzione della geometria del complesso.
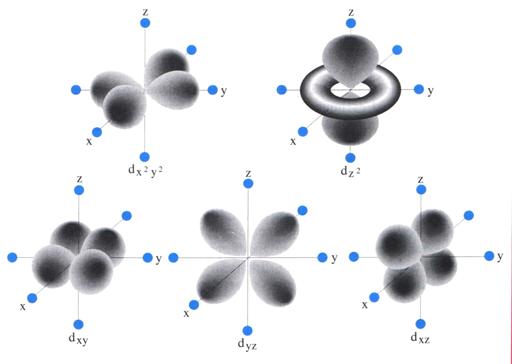
Teoria del Campo Cristallino
Energia degli orbitali d secondo CFT per Mn+
|
|
Pregi: semplicità, possibilità di trattamenti quantitativi della struttura elettronica: colore, magnetismo.
Difetti: Ignora la natura covalente del legame M-L
Teoria del Campo Cristallino
|
|
Gli orbitali molecolari impiegati sono ottenuti dalla combinazione lineare (L.C.A.O) di orbitali atomici del metallo e orbitali dei leganti.
Pregi: Riproduce la natura del legame
Difetti: Molto complicata nel produrre risultati quantitativi.
La CFT può essere vista come caso estremo dell OM. Tutte le teorie intermedie che vanno dalla CFT all'OM, prendono il nome di: teoria del campo dei leganti
Composti di Coordinazione
Colore e Magnetismo
Una delle proprietà più importanti dei complessi di coordinazione è il colore
Sono composti colorati, i loro spettri di assorbimento mostrano dei picchi in una regione che va dal visibili al vicino infrarosso (400-1000 mm).
I composti di coordinazione sono magneticamente attivi e variano tale proprieta' a seconda che si trovino in una situazione di alto o basso spin
Esempio complesso ottaedrico:
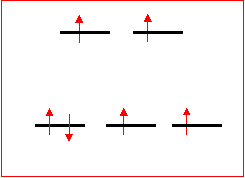
[Fe(H2O)6]2+ alto spin
4 elettroni spaiati
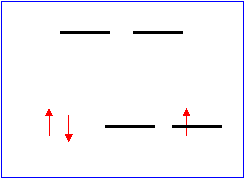
[Fe(CN)6]4- basso spin
![]() 0 elettroni spaiati
0 elettroni spaiati
![]()
![]()
![]()
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025