|
|
| |
Alcune proprietÓ misurabili di un sistema rimangono inalterate ogni volta che il sistema si trova in un determinato stato termodinamico. Le variabili che descrivono tali 545h73f proprietÓ sono chiamate variabili di stato.
L'energia interna (U) di un sistema Ŕ la somma di tutte le energie cinetiche e potenziali possedute dagli atomi o molecole del sistema steso.
Per un gas ideale monoatomico:
![]()
Essendo l'energia intera una funzione di stato, le variazioni di U dipendono soltanto dagli stati iniziale e finale del sistema, e non dal tipo di trasformazione.
La prima legge della termodinamica
Per un sistema:
(calore aggiunto al sistema) = (aumento di energia interna al sistema) + (lavoro compiuto dal sistema sull'ambiente)
Tale affermazione Ŕ conosciuta come prima legge della termodinamica. In forma di equazione:
Q = DU + L
Un diagramma PV Ŕ un grafico nel quale Ŕ riportata la pressione di un sistema in funzione del volume; tale diagramma Ŕ utilizzato per evidenziare, nel caso dei gas, le trasformazioni di stato che comportano una variazione di volume significativa. Ogni suo punto rappresenta uno stato termodinamico e ogni sua linea rappresenta uno particolare processo di trasformazione di stato.
Esistono trasformazioni dello stato termodinamico, durante le quali una grandezza rimane costante. Per tali trasformazioni, la prima legge della termodinamica prende le forme seguenti:
isobarica (a pressione costante): Q = DU + nRDT
isovolumica (a volume costante): Q = DU
isotermica (a temperatura costante): Q = L
adiabatica (senza scambio di calore): DU = - L
Se un gas ideale subisce una trasformazione adiabatica da P1, V1, T1 fino a P2, V2, T2, allora
P1V1g = P2V2g
Dove g = Cp / Cvá per il gas.
![]() (gas monoatomico)
(gas monoatomico)
![]() (gas
formato da molecole poliatomiche)
(gas
formato da molecole poliatomiche)
Approssimativamente, K Ŕ un numero intero, il cui valore dipende dal tipo di gas e dalla sua temperatura.
Cp = Cv + R (per tutti i gas)
Il lavoro dipende dal tipo di trasformazione, in particolare, abbiamo:
trasformazione isobarica: L = PDV
trasformazione isovolumica: L = 0
trasformazione isotermica: 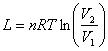
trasformazione adiabatica: L = -DU
Il lavoro dipende dal tipo di trasformazione, in particolare, abbiamo:
trasformazione isobarica: Q = nCpDT
trasformazione isovolumica: Q = nCvDT
trasformazione isotermica: 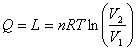
trasformazione adiabatica: Q = 0
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024