|
|
| |
Determinare il calore specifico di due sostanze diverse.
Due cilindretti di materiale diverso si portano alla temperatura di circa 100 °C (in questa esperienza, 99.1 °C), e vengono immersi in due calorimetri delle mescolanze differenti, riempiti di acqua a temperatura ambiente. Il nostro materiale caldo cede calore all'acqua, avviene cioè un passaggio di calore dal corpo a temperatura maggiore a quello a temperatura minore. Questo trasferimento di 757f53h energia si interromperà quando i due corpi avranno la stessa temperatura, raggiungendo così la condizione di equilibrio termico. La quantità di calore ceduta dal cilindretto è uguale alla quantità di calore acquistata dall'acqua e dal calorimetro.
ΔE ceduto = ΔE assorbito
quindi
ΔE ceduto = c H20 * m * (t2-te)
E assorbito= c H20 * m H20 * (te-t0)
Dobbiamo considerare però che il calore ceduto dal corpo caldo viene assorbito in parte dall'acqua fredda e in parte dal calorimetro; perciò, non potendo calcolare il calore acquistato da esso, utilizziamo la massa equivalente me di acqua che assorbirebbe la stessa quantità di calore del calorimetro (in questo caso 20g).
Quindi l'equazione diventa
c * m *(t2-t) = c H20 * me * (te-t
svolgendo l'equazione avremo
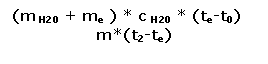
c=
Termometri
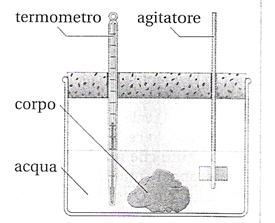
Calorimetro delle mescolanze: costituito da un recipiente a tenuta termica, all'interno del quale viene inserita una massa mH O di acqua a temperatura ambiente t1, chiuso da un coperchio nel quale sono inseriti un termometro per stabilire la misura dell'acqua e un agitatore.
Cilindretti di materiali diversi
Bilancia
Fornellino
Acqua
Recipiente
|
Materiale |
m Massa solida (g) |
m H O + me (g) |
t0 (°C) |
t2 (°C) |
te (°C) |
Cs kcal/(kg °C)] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Conclusioni
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025