|
|
| |
Per velocità di reazione si intende la variazione di concentrazione di reagenti o di prodotti nell'unità di tempo. Cioè è la quantità di reagenti che si trasforma o la quantità di prodotti che si forma in un determinato tempo.
Ci sono reazioni velocissime o istantanee 444e46e ( avvengono in frazioni di secondo come le esplosioni) e reazioni lente che richiedono giorni (es. la formazione di ruggine).
Natura dei reagenti: quando riverifica una reazione chimica si rompono i legami dei composti di partenza e se ne formano di nuovi. La velocità con cui ciò può accadere dipende innanzitutto dal tipo di questi legami e quindi dalla natura dei reagenti; legami complessi richiedono più tempo per essere demoliti e costruiti.
Concentrazione: aumentando la concentrazione delle specie chimiche reagenti, la velocità di reazione aumenta
Temperatura: aumentando la temperatura aumenta la velocità di reazione
Catalizzatori: la presenza di catalizzatori aumenta la velocità di reazione. I catalizzatori sono sostanze che accelerano le reazioni senza prendervi parte, cioè alla fine della reazione li ritrovo inalterati.
Per spiegare i punti 1,2,3 si ricorre alla teoria delle collisioni. Secondo questa teoria , affinché due specie chimiche possano reagire fra loro devono:
Quindi la natura dei reagenti influenza la velocità in quanto i legami possono essere più o meno forti e complessi e difficili da rompere e la forma della molecola può rendere l'urto più o meno efficace.
La concentrazione aumenta il numero di urti e quindi la probabilità di urti efficaci
La temperatura aumenta l'energia cinetica e la velocità delle particelle e quindi l'efficacia degli urti.
Invece l'efficacia dei catalizzatori si spiega ipotizzando che i catalizzatori richiamino sulla loro superficie le specie chimiche reagenti e pertanto ne facilitino l'incontro. Una seconda teoria ammette che la superficie dei catalizzatori adsorba ossia leghi a se le sostanze cje devono reagire ed esplichi un'azione di indebolimento o adirittura di rottura dei legami.
Si dice reversibile una reazione che può avvenire in entrambe le direzioni. La reversibilità viene indicata da due frecce con versi opposti tra reagenti e prodotti.
![]()
![]() A + B C + D
A + B C + D
Inizialmente la reazione diretta verso destra avviene rapidamente poiché la concentrazione dei reagenti è la massima possibile; col procedere della reazione la concentrazione dei reagenti diminuisce e con essa la velocità di reazione, mentre interviene la reazione inversa (verso sinistra) che diventa sempre più veloce con l'aumentare della concentrazione dei prodotti.
Ci sarà quindi una velocità V1 della reazione verso destra che va diminuendo , e una velocità V2 verso sinistra che va aumentando col passare del tempo. Ne consegue che ad un dato momento le due velocità V1 e V2 saranno uguali e quindi saranno uguali il numero di trasformazioni verso destra e verso sinistra; pertanto in questo momento le quantità dei reagenti e dei prodotti non cambiano più e la reazione si dice in equilibrio.
Riassumendo: una reazione reversibile è in equilibrio quando le velocità di reazione nei due versi sono uguali e pertanto le concentrazioni delle specie chimiche non cambiano più.
![]()
![]() Nella generica reazione reversibile A + B C + D
Nella generica reazione reversibile A + B C + D
Indichiamo con V1 la velocità della reazione verso destra e con V2 la velocità della reazione verso sinistra. Poiché la velocità di reazione dipende da una costante k, caratteristica per ogni reazione, e dalla concentrazione dei reagenti, possiamo scrivere:
V1 = K1 [A] [B]
V2 = K2 [C] [D]
All'equilibrio V1 = V2 e quindi anche K1 [A] [B] = K2 [C] [D] Risolvendo si ha:
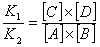
poiché K1 e K2 sono due costanti, anche il loro rapporto è una costante e potremo scrivere:
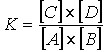
Questa relazione esprime la legge dell'azione di massa che afferma che:
A temperatura costante, all'equilibrio è costante il rapporto tra il prodotto delle concentrazioni dei prodotti di reazione e il prodotto delle concentrazioni dei reagenti.
La costante di equilibrio quindi esprime il rapporto tra i prodotti e i reagenti: pertanto più elevato sarà il valore di K, più alta sarà la concentrazione dei prodotti rispetto a quella dei reagenti. Fornisce perciò una indicazione della direzionalità predominante della reazione.
Se in un sistema in equilibrio viene variato il valore di un fattore che lo regola, il sistema reagisce variandone altri in modo da mantenere inalterato finché possibile , il suo stato di equilibrio.
Cioè quando un equilibrio viene in qualche modo disturbato dall'esterno, il sistema reagisce in modo da annullare il disturbo e ristabilire l'equilibrio.
Pertanto aumentando la concentrazione di uno dei reagenti, la reazione si sposta verso destra,
aumentando la concentrazione dei prodotti, la reazione si sposta verso sinistra.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025