|
|
| |
Relazione di CHIMICA
Oggetto: Studio dei Fattori che influenzano il decorso delle reazioni chimiche.
Esercitazione:
Nell'esperimento eseguito nel laboratorio di chimica è stato applicato il concetto di velocità di reazione.
Alcune reazioni, per avvenire, richiedono un tempo breve (ad esempio la combustione), mentre altre hanno un decorso estremamente lungo (ad esempio le trasformazioni chimiche che avvengono nelle rocce).
La cinetica chimica ci permette di stabilire la velocità con cui avviene una reazione chimica e, inoltre, ci fornisce utili informazioni circa il meccanismo attraverso il quale il processo chimica si evolve.
Durante un processo chimico le sostanze si combinano tra loro, in modo più o meno spedito, per formare i cosiddetti prodotti della reazione. Pertanto la rapidità con cui i reagenti scompaiono, o con cui i prodotti si formano, corrisponde alla velocità di reazione.
Sperimentalmente è possibile dimostrare che la velocità di una reazione dipende da alcuni fattori; noi verificheremo i seguenti:
CONCENTRAZIONE DEI REAGENTI:
Se i reagenti sono presenti in quantità notevole, grande è la probabilità che essi si incontrino e reagiscano e che quindi la velocità di reazione sia elevata.
TEMPERATURA DEI REAGENTI:
Più la temperatura dei reagenti è elevata, più sarà veloce il processo di reazione. 545j99f
CATALIZZATORE:
La sua funzione è quella di diminuire l'energia di attivazione(energia che deve essere necessariamente posseduta dai reagenti per trasformarsi in prodotti). La presenza di un catalizzatore provoca quindi un aumento della velocità di reazione.
AGITAZIONE:
Si è alla presenza di un'agitazione molecolare(sottoporre la reazione a movimenti od oscillazioni) che diminuisce il tempo di durata della reazione.
DI COSA BISOGNA DISPORRE?
6 coppie di
provette, 6 becker, beuta da 500 ml, termometro con portata max di
Nella prova effettuata abbiamo, quindi, sperimentato i fattori elencati poc'anzi; con ciò abbiamo dimostrato che ci sono delle differenze di velocità di reazione. Per dimostrare queste differenze bisogna usare dei metodi di sperimentazione diversi secondo i fattori.
CONCENTRAZIONE
Per vedere le differenze di velocità, abbiamo diminuito la concentrazione della soluzione aggiungendo ad ogni prova (6 prove in totale) 5 ml di H2O, partendo da 0 ml. Abbiamo notato, infatti, che il tempo impiegato dalla reazione aumentava di volta in volta.
COSA BISOGNA FARE?
R=ml KMnO4 e V=mlKMnO4
mlTOT mlTOT . sec
Da queste formule definiremo la velocità di reazione di ogni campione.
AIUTO: Per poter accorgersi meglio del cambio del colore della soluzione, portare il becker con la soluzione su un foglio bianco.
TEMPERATURA
A differenza della
concentrazione, per verificare le variazioni di velocità, abbiamo aumentato di
volta in volta la temperatura di
COSA BISOGNA FARE?
V=mlKMnO4
mlTOT . sec
CATALIZZATORE
Con questo altro fattore, determineremo la differenza di velocità tra le due coppie di reagenti, mettendo nella prima coppia il catalizzatore e lasciando la seconda coppia senza. Il catalizzatore ha velocizzato il processo di reazione di 87,34 secondi.
COSA BISOGNA FARE?
AGITAZIONE
L'ultimo fattore è simile al precedente; l'unica differenza è
che al posto di mettere il catalizzatore, sottoporre la coppia di reagenti ad oscillazioni (agitazione molecolare).
COSA BISOGNA FARE?
NB: Potrebbe capitare che per esempio la quinta reazione impieghi meno tempo della quarta, ma è normale. Non per questo sono state fatte 6 prove.
DOMANDE:
Al passaggio di concentrazione dei reagenti di ogni campione si nota che il tempo impiegato dalla reazione è maggiore. Questo sta a dire che meno sono concentrati i reagenti, più tardi avverrà la reazione. Questo è dovuto all'aumento di 5ml di H2O ad ogni soluzione di ciascuna prova.
V=mlKMnO4 (la risposta si trova nella tabella 1)
mlTOT . sec
[vedere la tabella1 con grafico]
V=mlKMnO4 (la risposta si trova nella tabella 2)
mlTOT . sec
Commenta i dati della tabella 2:
Al di là degli errori fatti durante la prova, si vede che il tempo di reazione diminuisce bruscamente, aumentando di volta in volta la velocità di reazione; tutto ciò è dovuto al fatto che con l'aumento della temperatura, c'è anche l'aumento della velocità di reazione.
[vedere la tabella2 con grafico]
Si nota dai dati ottenuti, che se sottoposte a questi fattori, le reazioni avvengo in un tempo minore, e quindi con velocità maggiore. Catalizzatore e agitazione intervengono negli stadi intermedi.
Il tutto è dato dal fatto che stava avvenendo la reazione e quindi la soluzione subisce varie trasformazioni.
![]() 2 KMnO4 +5H2C2O4+3H2SO4 2MnSO4+K2SO4+10CO2+8H2O
2 KMnO4 +5H2C2O4+3H2SO4 2MnSO4+K2SO4+10CO2+8H2O
![]()
![]() 2 Mn + 5e- Mn
2 Mn + 5e- Mn
![]() 5 C2 - 2e-
5 C2 - 2e-
![]() 2Mn + 10 e-
+ 5C2 - 10 e-
2Mn +
2Mn + 10 e-
+ 5C2 - 10 e-
2Mn +
CONCENTRAZIONE
|
CAMPIONE |
KMnO4 (ml) |
H2C2O4 (ml) |
H2SO4 (ml) |
H2O (ml) |
R (ml) |
Tempo (sec) |
Velocità (sec) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
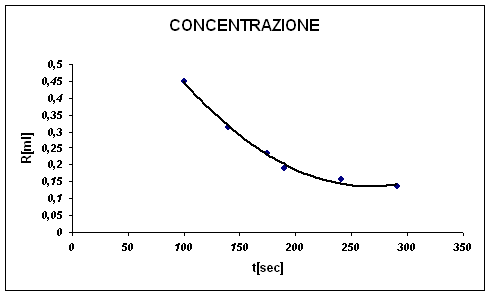
Dall'analisi del grafico notiamo che ci sono dei punti dove si nota benissimo che c'è un ampio margine di errore. Non per questo l'iperbole non è molto precisa. L'iperbole ha un andamento ideale.
Da questo capiamo che: all'aumentare dell'H2O, e quindi, al diminuire della concentrazione, la velocità di reazione diminuisce; questo comporta l'impiego di maggiore tempo.
Sull'asse
delle Y mettiamo
R* = ml KMnO4
mlTOT
TEMPERATURA
|
CAMPIONE COPPIA |
Temperatura (°C) |
Tempo (sec) |
Velocità (sec) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
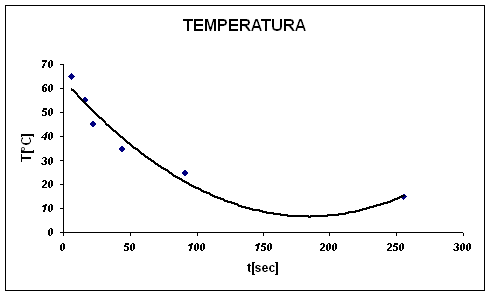
Anche da questo grafico, possiamo capire che gli errori commessi durante l'esperienza hanno influito in buona percentuale.
L'imprecisione si nota subito nei primi valori.
Da qui invece capiamo che: più la temperatura è alta, meno tempo impiegherà la reazione ad avvenire.
Sull'asse delle ordinate mettiamo la temperatura espressa in °Celsius, mentre sull'asse delle ascisse mettiamo il tempo espresso in secondi.
CATALIZZATORE
|
COPPIA REAGENTI |
KMnO4 (ml) |
H2C2O4 (ml) |
H2SO4 (ml) |
CATALIZZARORE |
Tempo (sec) |
|
|
|
|
|
Si |
|
|
|
|
|
|
no |
|
AGITAZIONE
|
COPPIA REAGENTI |
KMnO4 (ml) |
H2C2O4 (ml) |
H2SO4 (ml) |
AGITAZIONE |
Tempo (sec) |
|
|
|
|
|
Si |
|
|
|
|
|
|
no |
|
SCHEMA:
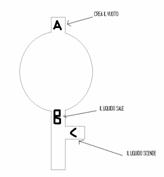
PROPIPETTA:
Pigiando "A" e comprimendo la palla piena di aria, nella propipetta si creerà il vuoto. Premendo "B", possiamo far salire il liquido; se il liquido è in eccesso, basta schiacciare "C" che il liquido scende.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025