|
|
| |
PRINCIPALI TIPI DI COMPOSTI
COMPOSTI DEI METALLI
OSSIDI
Gli ossidi sono dei composti contenenti un metallo e l'ossigeno:
metallo + ossigeno ossido
Esempio: ossido di sodio
Na + O2 Na2 O bilanciata 4Na + O2 2Na2O
Il sodio essendo del primo gruppo, forma uno ione con u 525d33f na carica positiva, Na+. Occorrono allora due Na+ per ogni ione O-2.
Altri esempi:
Mg + O2 MgO Fe + O2 FeO K + O2 K2O
Al + O2 Al2O3 Cu + O2 Cu2O Mn +O2 MnO2
IDROSSIDI
Gli idrossidi sono composti ionici contenenti ioni metallici e ioni OH- (ione ossidrile) e si ottengono per reazione fra un ossido e l'acqua:
ossido + acqua idrossido
Esempio: idrossido di sodio
Na2 O + H2 O NaOH bilanciata Na2 O + H2 O 2NaOH
Il sodio, essendo un elemento del I gruppo, forma ioni Na+; l'idrossido quindi ha la formula NaOH.
Altri esempi:
MgO + H2 O Mg (OH) 2 Al2O3 + H2 O Al (OH) 3 Cu2O + H2 O Cu (OH) 2
Idrossido di magnesio Idrossido di alluminio Idrossido rameico
COMPOSTI DEI NON METALLI
IDRACIDI
Gli idracidi sono composti contenenti un non metallo e l'idrogeno:
non metallo + idrogeno idracido
Esempio: acido fluoridrico
F2 + H2 2HF
ANIDRIDI
Le anidridi sono composti contenenti un non metallo e l'ossigeno:
non metallo + ossigeno anidride
I non metalli presentano in genere più di un numero di ossidazione. Quindi, spesso uno stesso non metallo forma varie anidridi, nelle quali assume numeri di ossidazione diversi.
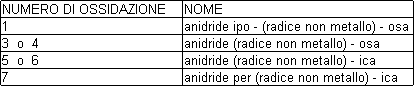
Esempio: le reazioni di formazione delle anidridi del cloro
2Cl2 + O2 2Cl2 O anidride ipoclorosa
2Cl2 + 3O2 2Cl2 O3 anidride clorosa
2Cl2 + 5O2 2Cl2 O5 anidride clorica
2Cl2 + 5O2 2Cl2 O7 anidride perclorica
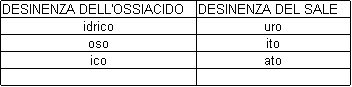
OSSIACIDI
Gli ossiacidi sono composti che si ottengono dalla reazione fra un'anidride e l'acqua:
anidride + acqua ossiacido
Sono composti contenenti tre elementi: il non metallo, l'idrogeno e l'ossigeno.
Esempio: acido solforico
SO3 + H2 O H2SO4
Le formule degli ossiacidi più comuni sono:
H3PO4 acido fosforico
HNO2 acido nitroso
HNO3 acido nitrico
H2CO3 acido carbonico
H3BO3 acido borico
HIO3 acido iodico
HIO4 acido periodico
I SALI
I sali sono composti che si originano dalla reazione di un idrossido con un acido secondo l'equazione generica:
idrossido + acido sale + acqua

I SALI BINARI
I sali binari sono composti formati:
metallo + non metallo sale binario
idrossido + idracido sale binario
metallo + idracido sale binario
Generalmente per formare questi sali si usano le valenze più basse dei non metalli.
Esempi: metallo + non metallo
Ca + Cl2 CaCl2 ( cloruro di calcio)
2K + Br2 2KBr ( bromuro di potassio)
Esempi: idrossido + idracido
NaOH + HCL NaCl + H2 O ( cloruro di sodio )
Cu (OH) 2 + HI CuI2 + H2 O ( ioduro rameico)
Esempi: metallo + idracido
Fe (OH) 2 + HCl FeCl2 + H2 O ( cloruro ferroso)
I SALI TERNARI
I sali ternari sono formati da tre elementi MXO.
idrossidi + ossiacidi sale ternario
idrossido + anidride sale ternario
ossido basico + ossido acido sale ternario
metallo + ossiacido sale ternario
Per questi sali bisogna usare una nomenclatura a parte:
Esempio: idrossido + ossiacido
Na (OH) + H2SO3 Na2So3 + H2 O
Esempio: idrossido + anidride
Na (OH) + SO3 Na2 (So4) + H2 O
Esempio: ossido basico + ossido acido
Na2 O + CO2 Na2CO3
Esempio: metallo + ossiacido
Na + HNO3 NaNO3 + H2
I SALI ACIDI
Il bicarbonato di sodio, ad esempio, ha quattro sostanza all'interno della molecola (NaHCo3). Se la dissociazione è parziale può reagire con un ossido basico o con un idrossido. Il nome di questi sali si fa precedere dal prefisso bi-
Esempio:
H3PO4 + K(OH) KH2 PO4 + H2 O
H+ + H2PO4
K+ + (OH)-
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025