|
|
| |
Giorno 10 marzo 2005 ci siamo recati in laboratorio per eseguire l'esperimento del saggio alla fiamma dei seguenti elementi e composti:
SCOPO DELL'ESPERIENZA: Osservare le diverse colorazioni che assume la fiamma ogni
qual volta ossida un diverso elemento chimico. 727h72h
Dal momento che gli atomi dei vari elementi posseggono una particolare struttura elettronica è possibile identificarli attraverso lo studio delle frequenze degli spettri di emissione.
I saggi alla fiamma si basano infatti sulla proprietà degli atomi di emettere radiazioni luminose quando vengono opportunamente eccitati da una sorgente di energia, in particolare dal calore emesso da una fiamma.
MATERIALE UTILIZZATO:
DESCRIZIONE DEL MATERIALE:
REAGENTI:
ESECUZIONE DEL SAGGIO:
I saggi vengono eseguiti umettando con acido cloridrico concentrato l'estremità di un filo di platino opportunamente fissato ad una bacchetta di vetro. Esso poi viene intinto nella sostanza da analizzare che è stata previamente polverizzata in un mortaio in modo che piccole quantità possano aderire al filo. E' sempre importante che il filo di platino sia ben pulito; ciò può essere fatto immergendolo ripetutamente in acido cloridrico concentrato e portandolo alla fiamma finchè non dia lacuna colorazione. Per il saggio vero e proprio il filo con la sostanza viene esposto alla parte più calda della fiamma ossidante: si potranno così osservare le varie colorazioni da cui risalire all'identificazione degli eventuali elementi presenti.
Nella tabella sotto riportata vengono elencati i vari colori osservabili.
|
SOSTANZA CHIMICA |
COLORAZIONE DELLA FIAMMA |
|
Litio |
Rosso carminio |
|
Bario |
Verde giallastro |
|
Rame |
Verde |
|
Cloruro di sodio |
Giallo |
.
OSSERVAZIONI E CONCLUSIONE:
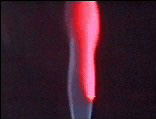
 LITIO RAME
LITIO RAME


BARIO CLORURO DI
SODIO
I saggi eseguiti alla fiamma sono in un certo qual modo una prova sperimentale degli spetri di emissione (colorazione fiamma) dovuti alle transizioni degli elettroni eccitati dall'energia termica sprigionata dalla fiamma. Se si potesse esminare, infatti, la colorazione emessa dalla fiamma attraverso uno spettroscopio si osserverebbe delle righe parallele colorate, in numero e disposizione diversi per ciascun elemento. La colorazione, pertanto, non è altro che la radiazione corrispondente alle righe predominanti dello spettro ed è di fatto una proprietà distintiva di ciascun elemento.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025