|
|
| |
LE PROTEINE
Di importanza primaria per la vita, i protidi o proteine nell'uomo costituiscono il 16% del peso corporeo ed il 50% del "residuo organico" (ciò che rimane tolta l'acqua e gli elettroliti). A parte le proteine fibrose, sono molecole in genere solubili in acqua. Svolgono numerose funzioni vitali: strutturale, enzimatica, ormonale, contrattile, respiratoria, di sostegno intra- ed extra-cellulare, etc. Sostanze quaternarie, composte cioè da C, H, O, N (cui spesso si associa lo zolfo, S), sono costituite da aminoacidi.
Gli aminoacidi (aa) utilizzati per la costruzione delle proteine sono 20, tutti con radicale (R) abbastanza semplice (il loro p.m. medio è di 120 dalton); si distinguono in aa neutri, con R che non porta gruppi acidi né basici, aa acidi (acido aspartico, acido glutammico), con -COOH nel R, e aa basici (arginina, lisina, istidina), con gruppi basici = NH o -NH nel R; uno di essi infine, la cisteina è solforato.
Gli aminoacidi si legano fra di loro mediante legame peptidico, con eliminazione di una molecola di H O. Si formano così lunghe catene lineari, polipeptidi se gli aa sono in numero inferiore a 100, proteine si gli aa sono 100 o più. Si noti che ogni catena, a prescindere dalla sua lunghezza, ha un'estremità aminica ed un'estremità carbossilica.
Funzione di struttura: presentano una forma allungata, fibrosa; ad es. il collageno è una proteina con forma allungata, componente fondamentale del tessuto connettivo. Il collageno è il biomateriale più rappresentato nel mondo animale, infatti come abbiamo già detto, e presente nei tessuti connettivi. Altro esempio e dato dalla cheratina, anch'essa presenta una tipica forma allungata, è materia costitutiva, fra le altre, dei capelli, unghie, cornee, etc. La fibrina invece è presente nel processo di coagulazione del sangue; il fibrogeno è il suo precursore (della fibrina), ed anch'esso ha una forma allungata.
Funzione enzimatica: gli enzimi sono i protagonisti principali del metabolismo; es. enzimi lisosomiali sono presenti all'interno delle strutture adibite a processi demolitivi di macromolecole, per recuperare i prodotti che verranno nuovamente riutizzati. Le proteasi sonoenzimi che demoliscono le proteine, invece le polimerasi sono sempre enzimi, ma il loro compito è quello di catalizzare il concatenamento di monomeri per formare polimeri.
Funzione di "canali": partecipano alla formazione della struttura di canali selettivi, con funzione di trasporto (vedi pompe)
Funzione di riconoscimento cellulare: un valido esempio può essere dato dagli antigeni presenti sulla superficie della membrana di alcune cellule, sono adibiti difatti al riconoscimento cellulare.
Funzione ormonale: sono gli ormoni, cioè i "messaggeri" chimici che regolano il funzionamento di organi situati 141j97b anche a grandi distanze rispetto a dove vengon
o prodotti gli stessi. Per es. l'insulina, ormone prodotto dal pancreas, è una piccola proteina, ma è di basilare importanza per il controllo della glicemia nel sangue, se è carente si può avere diabete.
Funzione di trasporto: classico esempio è dato dall'emoglobina (più approfonditamente analizzata nelle pagine successive), è il più importante vettore di ossigeno nei vertebrati. Come abbiamo poc'anzi detto, trasporta l'ossigeno, e nel suo "viaggio" di ritorno trasporta l'anidride carbonica. La mioglobina invece è una proteina presente nel tessuto muscolare dove svolge una funzione di riserva di ossigeno (O ), essa più che una proteina di trasporto è considerata una proteina di riserva, poiché "viaggia poco". Anche i citocromi sono poco impegnati nel trasporto, sono situati sulle creste mitocondriali.
Funzione di trattenimento di particolari ioni: alcune proteine sono capaci di immagazzinare il ferro (molto utile al nostro organismo) per non farlo eliminare a livello renale, successivamente quando la proteina che ha immagazzinato il ferro entra in circolo sanguigno, ce ne sarà un'altra che lo scinde dalla stessa. La trasferina aiuta il ferro a rimanere nel sangue a livelli costanti; nella milza e poi presente la ferritina, la caseina e la calmodulina.
Funzione contrattile: sono necessarie, fra le altre, per la contrazione muscolare, ed anche per la divisione cellulare (actina e miosina).
Funzione di difesa o "offesa": la funzione di difesa è svolta ad esempio con proteine presenti nel veleno di alcuni serpenti (tossine), le quali demoliscono i sfosfoaminolipidi che svolgono funzioni di isolanti elettrici, bloccano la funzione nervosa, etc.
Le proteine si possono classificare in due grandi categorie:
Proteine semplici: molecole proteiche dalla cui scomposizione si ottengono solo aminoacidi (AA).
Proteine coniugate: sono p. generalmente associate ad altri composti chimici (ad es.: al gruppo prostetico EME, ecc.) come le nucleoproteine e lipoproteine.
Possono esistere proteine insolubili aventi struttura fibrosa (cheratina) e proteine solubili aventi struttura rotondeggiante. Grossolanamente possiamo affermare che i composti monomerici delle proteine sono gli aminoacidi. Vedi quadro 2.5, pagina 62-63, Alberts terza edizione. Difatti vengono detti biopolimeri.
I singoli AA condizionano la forma della proteina nel citoplasma, la struttura a sua volta condiziona la loro funzione. Ci sono 20 diversi AA (vedi lista pagina 63 Alberts 3a ed.) la cui diversità è data loro dalla variabilità del radicale (R).
Gli AA possono essere suddivisi in tre gruppi:
I gruppo = AA apolari o idrofobici, sono provvisti di una catena laterale idrofobica. Tutti i loro radicali sono rappresentati da CH , CH ed anelli aromatici, nessuno dotato di carica.
II gruppo = polari sprovvisti di carica elettrica. NH non ha carica ma è reattivo, CH - SH (ad es.: cisteina), questo tipo di radicale ha come elemento reattivo lo S che forma i legami disolfuro nelle proteine, i quali stabilizzano la loro struttura tridimensionale ( si ha la formazione di una "graf di saldatura". Il gruppo CH - OH è un gruppo reattivo.
III gruppo = si oppone al I gruppo, ha caratteristiche contrarie, difatti nella catena laterale ci sono cariche elettriche (polari): NH (diamminomonocarbossilici) COO- (dicarbossilicimonoammina)
Per un approfondimento, come già ricordato, consultare pag. 62 e 63 Alberts 3a ed.
In una proteina si possono distinguere vari ordini di struttura:
Struttura primaria: riguarda la composizione chimica (n°. AA e loro relativa disposizione) che è strettamente collegata alla qualità. Il bisogno di conoscere le varie strutture proteiche inizia negli anni '40, in quanto per alcune proteine era urgente il bisogno di conoscere la loro struttura primaria. Lo studioso che per primo si occupò di questo con successo fu Sanger che ha ottenuto per questo ben due premi Nobel.
La struttura secondaria delle proteine: E' un livello di superiore di organizzazione delle proteine, rappresenta la conformazione, cioè la disposizione tridimensionale degli atomi in una molecola.
La proteina può assumere due tipi di conformazione tridimensionale:
A. Alfa elica: una singola catena polipeptidica si avvolge su se stessa regolarmente fino a formare un cilindro rigido nel quale ciascun legame peptidico si salda con legami a idrogeno ad altri distribuiti lungo la catena. Molte proteine globulari hanno una configurazione di questo tipo per brevi segmenti, mentre gran parte delle proteine strutturali si presentano come lunghi bastoncini analogamente con struttura ad alfa elica. Questa configurazione presenta un'ossatura principale di sequenza monotono dalla quale sporgono i vari residui laterali. Le interazioni sono di tipo debole (legami a idrogeno) e intracatenari e conferiscono alla struttura una discreta stabilità. La cheratina dei capelli ha una struttura secondaria ad alfa elica, lo stesso per la mioglobina e l'emoglobina. Le fibre della lana, per esempio, sono principalmente costituite da proteine ad alfa elica. Il capello umano per esempio è invece più stabile perchè i polipeptidi che lo compongono sono legati fraq loro anche da ponti di solfuro covalenti.
B. Foglietto beta-pieghettato: conformazione costituita da catene polipeptidiche parallele tenute insieme da interazioni deboli, legami H intercanetari. Lo scheletro di ogni polipeptide (o beta-filamento) in un foglietto beta assume una conformazione ripiegata o a organetto. Anche i foglietti beta si trovano in numerose proteine e poiché in questa forma, le catene di amminoacidi sono quasi completamente distese e resistono alle forze di trazione. La seta è una proteina con struttura secondaria a beta foglietto e deve la sua robustezza a questo tipo di architettura molecolare. La maggior parte di queste proteine assumono forme rotondeggianti.
Struttura terziaria delle proteine
Mentre la struttura secondaria dipende essenzialmente dalla sequenza degli amminoacidi nella catena polipeptidica, la struttura terziaria descrive la conformazione dell'intera proteina. La maggior parte delle proteine può essere classificata in base alla propria forma: ad esempio alcune proteine sono globulari, altre sono fibrose con forma estremamente allungata. La forma globulare si ottiene quando la proteina si avvolge su se stessa, come nella forma a gomitolo. Gli avvolgimenti non sono casuali: infatti uno dei fattori più importanti che determinano il ripiegamento del polipeptide consiste nella distribuzione delle sue catene laterali (polari e non polari). Durante la sintesi della proteina le catene laterali idrofobe tendono a segregarsi all'interno della molecola per evitare il contatto con l'ambiente acquoso, mentre quelle idrofile si dispongono in prossimità della porzione esterna per interagire con acqua ed altri gruppi polari.
Ma gli stessi legami peptidici sono legami polari, quindi tendono ad interagire sia con le catene laterali polari sia (tramite legami deboli idrogeno) fra di loro. Essendo quasi tutti residui a carattere polare situati all'interno della proteina, questi, interagendo con legami deboli, sono fondamentali nel mantenimento dell'integrità della catena polipeptidica situata nella proteina ravvolta. Queste proteine svolgono funzioni di tipo dinamico (ad esempio funzione di trasporto) e sono di forma rotondeggiante.
Molto importanti sono i gruppi prostetici nelle proteine coniugate poiché conferiscono stabilità alla struttura.
Interazioni tra residui non polari (o idrofobici)
Interazioni (o forze) di Van der Waals
Legami ad idrogeno
Interazioni ioniche o elettrostatiche
Legami disolfuri
Legami covalenti
Concludendo, possiamo affermare che la proteina presenta una buccia (cioè una superficie), sulla quale vi risiedono i residui idrofili, ed un core oleoso in cui si concentrano i residui idrofobici. E' possibile risalire alla conformazione di una determinata biomolecola grazie agli studi condotti con la diffrazione a raggi x: sono i cristallografi che determinano la geometria delle biomolecole e delle molecole inorganiche; quindi le informazioni che i biologi ottengono sono delle informazioni indirette.
Un esempio di come la cristallografia sia utile allo studio molecolare è dato dalla struttura della mioglobina:
la struttura della mioglobina è il modello didattico per eccellenza. E' la prima proteina globulare di cui è stata determinata la struttura terziaria; il merito di questa scoperta è di Kendrew e dei suoi collaboratori (nobel nel 1962) che adoperarono appunto la cristallografia a raggi x:
la proteina, cristallizzata, è bombardata dai raggi x; i raggi che poi vengono diffratti (o diffusi) dagli atomi della mioglobina impressionano una lastra fotografica producendo delle macchie. Macchie che a seconda della intensità, consentono di determinare la struttura proteica che le ha provocate.
La mioglobina ha funzione di riserva d'ossigeno nel tessuto muscolare: si tratta di una proteina coniugata, composta cioè da una parte proteica + un gruppo prostetico EME (che si lega con l'ossigeno). Kendrew condusse studi sulla muscolatura del capodoglio poiché i cetacei possiedono nei muscoli una grande riserva di mioglobina che occorre quando questi compiono immersioni prolungate.
Si tratta di una proteina composta da 153 amminoacidi che le conferiscono una forma concava, atta ad ospitare il gruppo EME.
Il gruppo prostetico EME è una struttura anulare all'esterno della quale si trovano dei residui idrofobici, mentre all'interno vi è l'atomo di ferro (Fe+). Si forma così una tasca idrofobica che consente al gruppo EME di legarsi con l'ossigeno senza far reagire l'atomo di ferro con l'ambiente acquoso: ciò porterebbe infatti ad un'ossidazione (=perdita di elettroni) irreversibile del ferro che non consentirebbe più la cattura dell'ossigeno.
La mioglobina non possiede ponti disolfuro e la sua struttura terziaria dipende da interazioni non covalenti come i legami idrogeno, i legami ionici e le interazioni idrofobiche. Oggigiorno sappiamo che la mioglobina possiede otto porzioni (o parti) della sua struttura terziaria ad alfa-elica.
Ogni proteina ha una struttura terziaria unica che è direttamente correlata con la sua sequenza di amminoacidi e quindi con la sua funzione biologica.
Le proteine possono andare incontro a processi di denaturazione che consistono nella perdita della propria struttura naturale (o nativa) e quindi della propria funzione.
Infatti nelle proteine globulari il "gomitolo" che si è creato tramite interazione di legami deboli all'interno, può "svolgersi". Chiari esempi sono l'enzima ribonucleasi e la proteina che si forma in caso di nefrite (=malattia causata da un difettoso filtraggio dei reni): in entrambi i casi l'agente denaturante principale (come lo è di tutte le proteine) è il calore ( nel secondo caso oltre al calore vi sono altri elementi come l'urea + un'agente riducente). Questo "sgomitola" le proteine perché agisce sui numerosissimi legami deboli situati all'interno. È importante però precisare che la denaturazione è uno svolgimento che conserva intatta la struttura primaria della proteina, in quanto né il calore né l'urea sono capaci di rompere i legami peptidici(difatti le proteine vengono denaturate per conoscerne la struttura primaria).
La denaturazione è un evento reversibile poiché man mano che si allontana dagli agenti denaturanti, la proteina tende a riavvolgersi e a ricostituire la struttura terziaria originale; ciò evidenzia il fatto che la disposizione di ogni singolo amminoacido all'interno della catena polipeptidica non è casuale, ma stabilisce la specifica struttura della proteina e la sua disposizione nello spazio.
DISEGNALE TE, TERE'! !!!!!
Queste particelle migrano se sottoposte ad un campo elettrico, ovvero quando vengono esaminate mediante elettroforesi, appunto. Il motivo è semplice: possedendo degli amminoacidi elettricamente carichi ubicati sulla superficie, anche le proteine si caricano elettricamente, e, se nella soluzione in cui si trovano viene applicato un campo elettrico, queste si spostano verso l'anodo o verso il catodo con velocità che dipende dalla loro dimensione, dalla carica risultante e dalla forma geometrica.
In conclusione, la tecnica nota come elettroforesi è impiegata per separare miscele di proteine presenti come tali in soluzione acquosa oppure su una matrice porosa solida (ad es. l'amido): grazie all'elettroforesi tutte le biomolecole provviste di carica elettrica possono essere evidenziate e separate.
In alcune proteine è presente anche la struttura quaternaria; la mioglobina ad esempio non la possiede in quanto è composta solamente da una catena polipeptidica: le proteine dotate di struttura quaternaria, invece, sono quelle composte da più catene o più subunità connesse tra loro da legami sia covalenti che non covalenti (nella maggior parte dei casi sono non covalenti). Le associazioni di più subunità che formano la struttura quaternaria, possono essere composte da due catene identiche (ed allora si le proteina sarà un omodimero), oppure da catene diverse (eterodimero). L'associazione di queste subunità ne determinerà anche la funzione.
Un esempio di proteina a struttura quaternaria è l'emoglobina: questa è costituita da quattro subunità, ha una forma rotondeggiante ed è presente nei globuli rossi (è infatti una cromoproteina, in quanto ne conferisce il colore).
La struttura dell'emoglobina è stata molto studiata (infatti è conosciuta a livello atomico) ed è inoltre una proteina di grande interesse perché una piccola variazione nella sua struttura ne compromette la funzione. Inoltre è una proteina di facile accesso allo studio in quanto non comporta grande lavoro e non reca danno al paziente cui viene prelevata.
L'emoglobina è il vettore di ossigeno più importante degli organismi viventi, e là dove non c'è l'emoglobina, vi è sicuramente un altro vettore che la sostituisce.
In questi ultimi anni è stata data molta importanza alle proteine, poiché la loro struttura è molto adatta alla costruzione di alberi filogenetici. L'evoluzione delle varie razze umane può essere agilmente studiata tramite lo studio dei suddetti alberi, per esempio analizzando le proteine formanti il DNA mitocondriale (ereditabile dalla sola madre, quindi essendoci un solo soggetto che lo trasmette si ha meno possibilità di mutazioni) si è potuti risalire alla certa origine del primo ominide. Un altro esempio è stato dato dall'isolamento del citocromo in tutta una serie di organismi, i quali hanno dato la possibilità ai ricercatori di svolgere uno studio evoluzionistico. Detto studio ha fatto riscontrare una certa variabilità in zone non strategiche (lontane dalla "regione" che circonda il gruppo EME) della proteina. Il fine di questa indagine è stato quello di dimostrare che le variazioni da organismo a organismo non riguardano la qualità della proteina, ma solo alcune regioni lontane dal gruppo EME, non importanti funzionalmente.
Riassumendo:
Le proteine sono specie specifiche (basti guardare che la scimmia, ha l'insulina molto simile alla nostra, in quanto nella scala zoologica la sua specie è simile alla nostra, ma via via che ci allontaniamo e diversifichiamo fra le varie specie di organismi viventi, notiamo che la somiglianza va sempre diminuendo).
Correlazione fra la struttura primaria delle proteine e la relativa evoluzione degli organismi viventi.
Le proteine possono essere sintetizzate anche artificialmente in laboratorio, difatti adoperando specifici macchinari che, tramite la semplice introduzione da parte del biologo di varie soluzioni contenenti i singoli AA, riescono a concatenarli assieme fino a formare la totale proteina, a patto che questa non superi i 50 monomeri circa (come per esempio l'insulina bovina e non).
Struttura primaria (da questa viene logicamente estrapolata la struttura tridimensionale della proteina, in quanto ogni singolo AA forma specifici legami intramolecolari).
La struttura primaria dà la possibilità di risalire al gene che codifica per quella specifica proteina, di conseguenza, dato che la sintesi proteica di ogni singola proteina è codificata da uno o più geni, se uno di questi non codifica esattamente, avremo una proteina non funzionale.
L'EMOGLOBINA
L'emoglobina è un vettore di ossigeno e, presente in quasi tutti gli esseri viventi, è un gigante molecolare che può essere costituito fino a nove pezzi ognuno dei quali è costituito da 1 parte proteica e 1 parte non proteica ma metallica: fa parte di quelle proteine che servono all'organismo per mantenere la scorta di O per tutti i tessuti. La sede dell'emoglobina è il globulo rosso, ognuno dei quali trasporta circa 3.000.000 molecole di questa proteina. Ogni globulo rosso vive circa tre mesi e poi va incontro a demolizione. La maggior parte degli organismi viventi usano questa proteine (che si presenta con lievi differenze, che comunque non ne variano la funzione) per portare O a tutti i tessuti.
|
|
Proteina |
Colore |
Elemento metallico |
Sede |
|
|
Emoglobina |
Rosso |
Fe |
Globuli rossi |
||
|
Emocianina |
Blu |
Rame |
Plasma |
||
|
Clorocrorina |
Verde |
Fe |
Plasma |
||
|
Emoeritrina |
Rosso |
Fe |
Globuli rossi |
||
|
|
|||||
L'ossigeno sarebbe in grado di sciogliersi nei tessuti senza bisogno di vettori, ma la presenza dell'emoglobina consente di verificare che la quantità di ossigeno è maggiore di 50 volte. Infatti, questa particolare proteina è presente nei così detti organismi superiori, cioè quelli che hanno una certa dimensione. Gli insetti per esempio non presentano un'organizzazione così articolata, in quanto il loro fabbisogno di ossigeno può essere soddisfatto con lo scioglimento diretto di questo. Nei pesci troviamo ancora un modo diverso: l'ossigeno viene catturato dalle branchie e poi entra direttamente in circolo attraverso superfici respiratorie.
Negli organismi in cui il sistema respiratorio è "aiutato" dall'emoglobina la cattura dell'ossigeno da parte di questa proteina avviene sulle superfici respiratorie, che poi lo trasporta fino ai tessuti periferici, che altrimenti non avrebbero modo di essere raggiunti dall'ossigeno.
Gli studi che hanno condotto alla scoperta e alla conoscenza approfondita dell'emoglobina furono condotti da Perutz, che per l'importanza delle conclusioni a cui arrivò ottenne il Premio Nobel nel !962.]
La capacità dell'emoglobina di "catturare" l'ossigeno porta subito alla conclusione che questa proteina debba avere una forte affinità all'ossigeno. Ma la constatazione immediatamente successiva è riguardo al momento in cui la proteina deve cedere l'ossigeno ai tessuti. In effetti, ci sono fattori che hanno un'importanza fondamentale nel processo di "cattura" e "rilascio" dell'ossigeno da parte dell'emoglobina:
|
Fattori che facilitino la cattura di O a livello polmonare |
Fattori che facilitino il rilascio di O a livello di tessuti |
|
Alta pressione parziale di O |
Bassa pressione parziale di O |
|
Bassa temperatura |
Alta temperatura |
|
Presenza di anidride carbonica (CO ) a bassi livelli |
Presenza di anidride carbonica (CO ) ad alti Livelli |
|
pH basico |
pH acido |
L'emoglobina è un tetramero composto appunto da 4 monomeri che sono catene peptidiche + un gruppo eme. Ogni monomero si chiama globina e per ogni emoglobina sono a coppie di due catene: due prendono il nome di alfa catene e due di beta catene.
![]()
![]()
![]() Globina
Globina
beta alfa

![]()
![]()
alfa beta
![]()
Emoglobina = 64.000 dalton
2 catene alfa +
2 catene beta.
Catena alfa = 141 aa
Catena beta = 146 aa
L'emoglobina grazie a questa conformazione può legare 4 molecole di ossigeno. Ha una forma rotondeggiante.
Il disegno sopra descrive un'emoglobina umana adulta, definizione che viene abbreviata con HbA. Si è recentemente scoperto che il 2% di emoglobine in un uomo adulto non sono HbA (alfa , beta ), ma risultano HbA (alfa , delta ). Fra HbA e HbA c'è differenza nella struttura primaria e non se ne conosce ancora la funzionalità.
Nei vari stadi della vita l'emoglobina umana varia nella struttura delle catene di tipo beta, proprio per sopperire ai bisogni nelle varie fasce di età:
|
Stadio |
Tipo |
Catene di tipo alfa |
Catene di tipo beta |
|
Embrione precoce |
HbGower1 |
alfa |
epsilon |
|
Embrione tardivo |
HbGower2 |
alfa |
epsilon |
|
Fetale |
F(HbF) |
alfa |
gamma |
|
Adulto |
A (HbA) A (HbA |
alfa alfa |
beta delta |
La variazione nella catena di tipo beta nell'emoglobina presente nello stadio fetale rende la proteina molto più affine all'ossigeno dell'emoglobina caratteristica dello stadio adulto. La funzionalità di questo è ovvia se si pensa che l'approvvigionamento d'ossigeno per il feto è possibile solo attraverso l'emoglobina materna alla quale deve strappare in pratica l'ossigeno.
Patologie ed anomalie causate da un errore nell'emoglobina
Ci sono patologie ereditarie che causano il mantenimento del tipo F(HbF) anche in età adulta: questo causa una sofferenza da parte del tessuto il quale non riesce a ricevere ossigeno dal momento che l'altissima affinità delle catene gamma non permette all'emoglobina il rilascio.
Una malattia legata alla mutazione dell'emoglobina è l'anemia (che indica la quantità scarsa di emoglobina) falciforme (che indica una percentuale di globuli rossi che a condizione di bassa pressione parziale di ossigeno, cioè ipossia, assumono forma a falce), che è una malattia genetica che si manifesta solo nei soggetti omozigoti.
Negli affetti da anemia falciforme l'emoglobina ha mostrato degli errori nella struttura primaria che causano gravi difficoltà di respirazione, in particolare ad alta quota.
Quando si andò a studiare l'emoglobina dei malati si notò come l'errore non fosse a livello della catena alfa, ma a livello della catena beta. Sottoposta all'elettroforesi (tecnica che distingue le proteine in base alla loro carica elettrica netta in un determinato tampone) si notò come questo frammento percorresse un percorso molto più lungo del solito. Si scoprì che nella posizione n° 6 c'era una differenza: nei soggetti normali in posizione 6 si trovava l'acido glutammico, che è un amminoacido idrofilo che presenta un carbossile che, dissociandosi, si carica negativamente; nei soggetti malati invece in posizione 6 si trovava una valina cioè un amminoacido idrofobo senza cariche.
Questo spiegò come mai a bassa pressione e al momento in cui ha ceduto l'ossigeno il globulo rosso assume una forma falciforme: il cambiamento di cariche fa sì che i 4 monomeri dell'emoglobina si appiccichino tra di loro a formare fasci allungati che premono contro le pareti del globulo rosso portandolo ad assumere una forma innaturale che intasa poi i capillari, provocando un mancato apporto di ossigeno(da cui nascono i dolori).
IL COLLAGENO
Il collageno è un complesso gigantesco che svolge la funzione di struttura ed è una proteina fibrosa.
L'assemblaggio del collageno avviene nei mioblasti:
All'interno della cellula si trova una cellula chiamata proalfacatena, cioè il più piccolo costituente di quello che diventerà l'enorme collageno.
Nell'apparato di Golgi il precursore viene modificato: una glicosilazione permette la selezione di alfacatene dalle proalfacatene.
![]() Il primo precursore
del collageno vero e proprio prende il nome di procollagenoed è formato da 3 alfacatene avvolte a spirale che agli
estremi rimangono sciolte con i tre filamenti liberi. Ogni procollagene è una
fune a tre capi lunga circa 3000 A .
Il primo precursore
del collageno vero e proprio prende il nome di procollagenoed è formato da 3 alfacatene avvolte a spirale che agli
estremi rimangono sciolte con i tre filamenti liberi. Ogni procollagene è una
fune a tre capi lunga circa 3000 A .
Il procollagenoo viene espulso dalla cellula e subisce un'ulteriore rifinitura, in quanto gli vengono tagliati quei "ciuffetti" esterni che non si erano avvolti fra di loro. L'enzima che compie questa operazione prende il nome di procollagenopeptidasi. (Ci sono patologie che comportano la deficienza di questo enzima, il che comporta un'anomalia nella costituzione del futuro collageno rendendo le strutture di cui fa parte, particolarmente elastiche). Il procollageno così rifinito prende il nome di protocollageno.
I legami che si instaurano fra queste catene sono legami ad idrogeno che conferiscono solidità per l'elevato numero , ma anche elasticità.
Ogni singolo monomero di protocollageno si dispone in file con una sfalzatura di ¼ della lunghezza. A livello microscopico questa disposizione si può notare da bande più o meno scure (dipendentemente che le radiazioni passino attraverso un punto in cui ci sono più o meno intersezioni vuote.
Le alfacatene che stanno alla base del collageno sono formate da circa 1000 amminoacidi tutti di taglia piccola per poter permettere una migliore torsione della catena. La fibra nasce da un numero elevatissimo di catene: i tendini sono fibre di collageno, e si trova in grande quantità anche nella pelle.
Si è calcolato che 1 mm di tendine può sostenere fino a 10 Kg di peso. La robustezza accompagnata alla elasticità la dobbiamo alle interazioni intracatenarie e al modo in cui sono avvolte le parti che lo costituiscono.
Si conoscono sette tipi di alfacatene (e, di conseguenza di collageno), che vengono indicate con i numeri romani da I a VII. Questi sette tipi diversi si possono assortire tra loro e formare un sacco ti tipi di collageno diversi.
Patologie ed anomalie causate da un errore nel collageno.
Alcune anomalie causate da una sbagliata composizione del collageno è la dermotosparassia o Sindrome di Ehlere.
In questo caso il collageno è molto fragile e si riscontra spesso negli animali cui a causa di ciò poi si piegano le gambe. Infatti, la robustezza del collageno è minata da una deficienza enzimatica che non permette la formazione corretta di legami intracellulari e intercellulari.
Il numero di questi legami aumenta con l'età ed è la causa della perdita di elasticità.
Per studiare il collageno bisogna necessariamente smontarlo con le alte temperature. Ma questo comporta la perdita dell'ordine che regna nella struttura del collageno (il collageno bollito si trasforma in gelatina).
L'INSULINA
L'insulina rappresentava l'unica terapia possibile per il diabete e negli anni '40 i diabetici ricorrevano ad insulina di origine bovina o ovina. Infatti questo ormone ha sempre lo stesso compito indipendentemente dall'organismo in cui si trova. Tuttavia i risultati di questa terapia erano scadenti perché con l'andar del tempo la somministrazione di insulina non dava più i benefici attesi. Il motivo di questo oggi è chiaro, perché si parla di proteina eterologa, cioè che pur avendo la stessa funzione, varia lievemente da organismo a organismo, e una volta introdotta in un corpo produce una reazione di difesa, con la produzione di anticorpi, che a lungo andare la rendono inefficace. Come terapia sostitutiva però all'epoca si provarono varie insuline di provenienza diversa ma ciò non cambiò i risultati.
Negli anni '50 però comunicò al mondo scientifico di essere riuscito ad individuare il numero e la natura di tutti gli amminoacidi che formavano l'insulina. In più fu brevettato un metodo per analizzare la struttura primaria delle proteine.
L'insulina è composta di 51 amminoacidi che si trovano su due catene tenute insieme tra loro da un ponte intercatenario di solfuro. Una catena denominata A presenta 20 aa e un ponte di solfuro intracatenario, mentre la catena B presenta 31 aa.
![]() Ponte intracatenario
Ponte intracatenario
![]()
![]()
![]()
![]()
![]() 20 aa
20 aa
![]()
![]()
![]()
![]()
![]()
![]() Ponte
intercatenario
Ponte
intercatenario
![]() 31 aa
31 aa
L'insulina perde le sue funzioni al momento che un amminoacido cambia o l'informazione del DNA al momento della sua sintesi è sbagliata.
Prima di diventare tale, l'insulina passa attraverso una serie di modificazioni, venendo tagliata dall'enzima peptidasi.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Prepoinsulina
Prepoinsulina![]()
![]()
![]()
![]()
![]() Preinsulina Insulina
Preinsulina Insulina
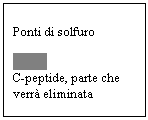
Il C-peptide è il peptide di connessione che viene poi eliminato dagli enzimi. Quella della proinsulina è uno strategia per avere a disposizione immediata insulina senza dover ricorrere alla produzione nelle cellule pancreatiche. Nelle persone diabetiche le strutture enzimatiche, cioè gli enzimi proteolitici non sono in grado di tagliare la proinsulina e la rpoteina entra in circolo non funzionale.
Samger, studiando l'insulina, dedusse che le proteine sono specifiche per ogni specie (bue, suino, pecora e uomo) benché in ogni specie esercitino la stessa funzione. La stessa proteina di specie diverse risulta avere una struttura primaria particolare e diversa dalle altre.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025