|
|
| |
INTRODUZIONE Legame chimico Legame responsabile della formazione delle molecole, che si determina in seguito alle forti interazioni tra atomi. Quando due o più atomi vengono posti a distanza ravvicinata, una forza attrattiva si manifesta tra gli elettroni dei singoli atomi e uno o più nuclei vicini: se tale forza è sufficientemente intensa da mantenere uniti gli atomi, si forma un legame chimico. Tutti i 212h76c legami chimici derivano dallo scambio o dalla condivisione di elettroni da parte di almeno due atomi.
TIPI DI LEGAMI Si definisce metallico il legame fra metalli; in questo caso, gli elettroni sono condivisi da tutti gli atomi e perciò sono in grado di muoversi liberamente nel solido, generando le diverse caratteristiche di conducibilità elettrica e termica, di lucentezza, di malleabilità e di duttilità proprie dei metalli.
Il legame covalente omeopolare si genera in conseguenza alla condivisione di almeno due elettroni da parte di una coppia di atomi uguali (come in N2 o O2): in questo caso gli elettroni di legame sono condivisi in ugual misura dai due atomi. Il legame covalente si dice polare se vi è una sensibile differenza di elettronegatività fra gli atomi che partecipano al legame; ciò avviene quando gli atomi sono di tipo differente, come ad esempio nell'ossido di azoto, NO: i due elettroni sono ripartiti in maniera ineguale fra gli atomi, e la loro densità di carica si concentra intorno all'atomo più elettronegativo. Si genera così una molecola dotata di un polo di carica debolmente positiva e uno di carica debolmente negativa. Il legame covalente è caratteristico di sostanze che non conducono l'elettricità, non hanno lucentezza, duttilità, né malleabilità.
In sostanze che contengono atomi di metalli e non-metalli, si instaura un legame ionico quando gli atomi del metallo, trasformati in ioni positivi (cationi), si legano con gli ioni negativi (anioni) del non metallo. Il legame ionico è un legame di tipo forte (ovvero caratterizzato da una elevata energia di legame) e non direzionale; la forza del legame è di natura puramente elettrostatica. Un composto caratterizzato da legame ionico è il cloruro di sodio (NaCl), in cui la forza di legame è sufficientemente intensa da garantire la coesione del cristallo. Grazie alla mobilità degli ioni, i composti ionici conducono l'elettricità quando sono in soluzione acquosa o allo stato liquido.
Nei legami covalenti omeopolari e metallici, pertanto, si ha una distribuzione omogenea di elettroni; una distribuzione eterogenea è invece alla base di legami covalenti polari; il completo trasferimento elettronico da un atomo all'altro caratterizza infine i legami ionici. Il tipo di legame che si forma è determinato dalla differenza di elettronegatività tra gli atomi coinvolti.
Nel caso del legame dativo, i due elettroni di legame provengono da un unico atomo: un atomo, definito "donatore", cede il proprio elettrone a un altro atomo, chiamato "accettore".
Il legame idrogeno si realizza quando un atomo di idrogeno, legato per mezzo di un legame covalente a un atomo molto elettronegativo (come O, N, F), forma un altro legame debole con un altro atomo elettronegativo che abbia una coppia di elettroni non condivisi. Questo legame è di natura elettrostatica, ed è notevolmente più debole dei normali legami covalenti: ciononostante ha un'enorme importanza. È responsabile dell'alto punto di ebollizione dell'acqua e dell'alto grado di viscosità della glicerina. Modifica la coesione di determinati cristalli, in particolare nel ghiaccio, e di fatto contribuisce a determinare il grado di massima stabilità di molte grandi molecole di importanza biologica.
VALENZA In un atomo, gli elettroni degli orbitali più interni sono attratti così intensamente dal proprio nucleo da non potere interagire con i nuclei degli atomi circostanti: solo gli elettroni che si trovano nelle zone più esterne dell'atomo, detti elettroni di valenza, riescono a partecipare nella formazione di legami chimici. Riferendosi alla notazione - benchè ormai quasi in disuso - dei numeri romani per distinguere i diversi gruppi della tavola periodica, il numero di elettroni di valenza è fornito dal gruppo cui l'atomo appartiene.
Così, gli elementi dei gruppi IA (o 1) e IB (o 11) hanno un solo elettrone di valenza; ne hanno due gli elementi dei gruppi IIA (o 2) e IIB (o 12) e quattro gli elementi dei gruppi IVB (o 4) e IVA (o 14). Tranne l'elio, tutti gli elementi dell'ottavo gruppo del sistema periodico (neon, argo, cripto, xeno e rado) hanno otto elettroni di valenza e sono gas poco reattivi, che esistono solo in forma monoatomica; in seguito alla scarsa reattività vengono chiamati gas nobili. La configurazione "completa" del guscio elettronico più esterno conferisce loro bassa energia, e quindi elevata stabilità. Con la formazione di legami chimici, tutti gli elementi tendono ad assumere la configurazione elettronica completa e stabile del gas nobile più prossimo nella tavola periodica. Tale comportamento è stato riassunto nella cosiddetta "regola dell'ottetto", enunciata dal chimico americano Gilbert Newton Lewis nel 1916.
I metalli nei gruppi IA (o 1) e IB (o 11) della tavola periodica tendono a perdere un elettrone per formare ioni con una carica positiva, quelli dei gruppi IIA (o 2) e IIB (o 12) tendono a perdere due elettroni e a formare ioni con due cariche positive; analogamente si verifica per gli altri gruppi. Gli alogeni (gruppo VIIA o 17) tendono ad acquistare un elettrone per formare ioni con carica negativa, mentre gli elementi del gruppo VIA (o 16) tendono ad acquistarne due, formando ioni con due cariche negative.
Un esempio di legame covalente è la molecola di cloro (Cl2): ciascun atomo ha 35 elettroni, uno in meno rispetto all'atomo di argo, il gas nobile più vicino nella tavola periodica, cosicché quando due atomi di cloro formano un legame covalente omeopolare condividendo due elettroni, entrambi raggiungono una configurazione elettronica con 36 elettroni. Generalmente si rappresenta la coppia di elettroni condivisi con la formula Cl Cl. Altro esempio è la molecola di ossigeno: l'atomo di ossigeno ha in totale otto elettroni, due in meno rispetto al gas nobile più vicino, il neon; quando due atomi di ossigeno si legano per formare la molecola O2, mettono in compartecipazione quattro elettroni, due per ogni atomo. In questo caso si forma tra i due atomi un doppio legame, O O. Allo stesso modo gli atomi di azoto nella molecola corrispondente condividono tre elettroni formando un legame triplo, N N. Nel diossido di carbonio, sia il carbonio (con sei elettroni propri) sia l'ossigeno (con otto) riescono a raggiungere il numero di elettroni del neon formando due doppi legami: O C O. In tutte queste formule di legame sono rappresentati solo gli elettroni coinvolti nei legami stessi.
Circa l'80% di tutti i composti covalenti può essere descritto ragionevolmente dalle strutture elettroniche di Lewis; i restanti composti, specialmente quelli che contengono elementi dei gruppi centrali della tavola periodica, spesso non riescono a trovare giustificazione sulla base del tentativo di raggiungere la configurazione elettronica esterna dei gas nobili.
RISONANZA Esistono alcuni casi particolari nei quali la struttura del composto non è rappresentabile con una sola formula di Lewis: ciò accade ogni volta che un legame non è strettamente localizzato fra due atomi della molecola. Questi casi, in cui il numero di elettroni di valenza è insufficiente a formare legami localizzati, ma richiede una condivisione non localizzata degli elettroni fra gli atomi, sono chiamati "risonanza". Si consideri ad esempio lo ione NO3-: l'azoto occupa la posizione centrale ed è circondato da tre atomi di ossigeno, sui quali è localizzata la carica negativa. Poiché non è possibile distinguere i tre atomi di ossigeno, si rappresentano tre formule di Lewis, in ciascuna delle quali ogni atomo raggiunge la configurazione elettronica esterna dell'ottetto. Tale situazione è rappresentabile nel seguente modo:
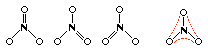
Il legame fra N e O è delocalizzato fra le tre posizioni possibili, così come la carica negativa non è localizzata su due atomi di ossigeno, ma ugualmente distribuita fra tutti e tre: la struttura del legame è quello di una molecola di forma definita, più un insieme di elettroni condivisi sull'intera molecola. Questo giustifica tutte le proprietà di simmetria e le osservazioni sperimentali secondo le quali tutti i legami sono identici sotto ogni aspetto, con proprietà intermedie fra quelle osservate per i singoli e i doppi.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025