|
|
| |
RELAZIONE SCIENTIFICA
VELOCITA' DI REAZIONE
In laboratorio abbiamo svolto due esperimenti legati alla velocità di reazione per verificare le nozioni teoriche apprese in classe. Abbiamo osservato come la velocità di una reazione può essere alterata da alcuni fattori, in questo caso abbiamo preso in esame la concentrazione dei reagenti e la temperatura.
ESPERIMENTO 1
Lo scopo del primo esperimento era osservare la variazione della velocità di una reazione al mutare della concentrazione dei reagenti e verificare che quest'ultima è direttam 828d31i ente proporzionale alla velocità.
MATERIALI:
- 5 beker(uno per ogni prova)
- cilindro graduato
- cronometro
- beuta contenente soluzione HCl 0,5M
- beuta contenente soluzione Na S O 0,5M
- spruzzetta con acqua distillata
- Pipetta graduata
- Carta da filtro
DESCRIZIONE ESPERIMENTO:
La prima fase dell'esperimento consiste nel preparare le 5 soluzioni di Na S O con concentrazioni molari differenti; per fare questo abbiamo effettuato una diluizione scalare della soluzione iniziale nel seguente modo:
avevamo una soluzione di tiosolfato di sodio(Na S O 0,5M, che sarà chiamata soluzione madre;
abbiamo posto in un beker 30 ml di soluzione e abbiamo aggiunto 30 ml di acqua distillata, attraverso il supporto di un cilindro graduato. Poi abbiamo preso metà della soluzione ottenuta e l'abbiamo posta in un beker, e su questa metà si effettuerà la prima prova dell'esperimento; mentre l'altra metà servirà per la preparazione delle altre soluzioni che avverrà nello stesso modo, cioè aggiungendo 30 ml di acqua distillata e dimezzando di volta in volta la concentrazione molare.
Dopo aver preparato le soluzioni necessarie, abbiamo preso un pezzo di carta da filtro, abbiamo disegnato al centro una croce di circa 3 cm e abbiamo posta sopra di essa il beker con la prima soluzione (0,5 M).
In seguito abbiamo fatto reagire l'acido cloridrico con il tiosolfato di sodio, aggiungendo alla soluzione nel beker 30 ml di soluzione HCl 0,5M tramite l'ausilio di un pipetta graduata.
Dopo abbiamo misurato con il cronometro il tempo che la reazione impiegava a produrre un numero sufficiente di prodotti che ci impedisse di vedere la crocetta sul fondo del beker. Questo metodo di valutare la velocità è detto end-point.
Questo procedimento è stato ripetuto altre quattro volte, con le soluzioni con concentrazioni molari dimezzate.
DATI E OSSERVAZIONI:
Dalle cinque prove abbiamo ottenuto i seguenti risultati:
|
|
I° |
II° |
III° |
IV° |
V° |
|
[Na S O ]mol/l |
|
|
|
|
|
|
tempo (s) |
|
|
|
|
|
|
1/t ( /s) |
|
|
|
|
|
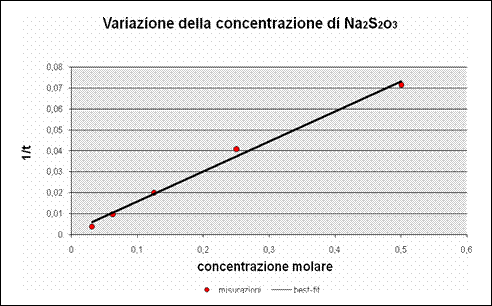
In questo grafico sono stati inseriti i dati raccolti durante l'esperienza in laboratorio, e si può notare come l'andamento di questi dati sia riconducibile ad una retta (linea di best-fit o linea di tendenza); inoltre è evidente dal grafico che ad un aumento della concentrazione corrisponde un aumento della velocità, e viceversa.
Questo conferma l'ipotesi iniziale poiché i tempi di reazione sono inversamente proporzionali alla concentrazione e di conseguenza la velocità con cui si formano i prodotti della reazione è direttamente proporzionale alla concentrazione dei reagenti.
I dati non seguono perfettamente l'andamento della linea di tendenza a causa di alcuni errori di imprecisione durante la preparazione delle soluzioni attraverso la diluizione scalare.
ESPERIMENTO 2
Lo scopo del secondo esperimento è osservare la variazione della velocità di una reazione al cambiare della temperatura dell'ambiente di reazione e verificare che l'aumento della temperatura porta ad un aumento esponenziale della velocità.
MATERIALI:
- 4 beker(uno per ogni prova)
- cilindro graduato
- acqua
- soluzione HCl 0,5M
- Soluzione Na S O 0,5M
- Pipetta graduata
- Carta da filtro
- cronometro
- termometro digitale ad immersione
- fornelletto elettrico
DESCRIZIONE ESPERIMENTO:
In questo esperimento abbiamo effettuato 4 prove, facendo reagire ogni volta 30 ml di acido cloridrico (HCl) 0,5 M con 30 ml di tiosolfato di sodio (Na S O ) 0,5 M e variando di volta in volta solamente la temperatura dell'ambiente di reazione.
La prima misura è stata effettuata su una soluzione di tiosolfato di sodio che era stata precedentemente portata a circa 6°(279 K).
Abbiamo misurato tramite l'utilizzo di un cilindro graduato 30 ml di soluzione e l'abbiamo messa in un beker; poi in modo analogo al precedente esperimento abbiamo preso un pezzo di carta da filtro, abbiamo disegnato al centro una croce e abbiamo posto sopra di essa il beker con la prima soluzione.
A questo punto abbiamo misurato la temperatura con il termometro digitale, che si era naturalmente alzata nel compiere le operazioni precedenti e aveva raggiunto circa i 12°(285 K) e abbiamo aggiunto 30 ml di HCl. Quindi abbiamo misurato con il cronometro il tempo che la reazione impiegava a produrre un numero sufficiente di prodotti che ci impedisse di vedere la crocetta sul fondo del beker (end-point).
Questo procedimento è stato ripetuto altre tre volte, con soluzioni con temperature diverse. Per ottenere temperature diverse è stato necessario riscaldare le soluzioni a "bagno maria", cioè mettendo la beutina contenente 30 ml di soluzione di Na S O in un beker contenente acqua posto su un fornelletto elettrico e facendo aumentare la temperatura fino a raggiungere quella necessaria.
DATI E OSSERVAZIONI:
Dalle quattro prove abbiamo ottenuto i seguenti risultati:
|
|
I° |
II° |
III° |
IV° |
|
temperatura (K) |
|
|
|
|
|
tempo (s) |
|
|
|
|
|
1/t ( /s) |
|
|
|
|
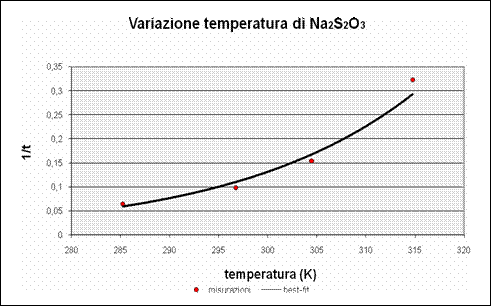
In questo grafico sono stati inseriti i dati raccolti durante l'esperienza in laboratorio, e si può notare come l'andamento di questi dati sia riconducibile ad una iperbole (linea di best-fit); inoltre è evidente dal grafico che ad un aumento della temperatura corrisponde un rapido aumento della velocità e proprio grazie al grafico possiamo dimostrare che questo andamento è esponenziale.
Questo conferma l'ipotesi iniziale che l'aumento della temperatura porta ad un aumento esponenziale della velocità.
I dati non seguono perfettamente l'andamento della curva a causa di errori sperimentali.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024