|
|
| |
PREPARAZIONE E CRISTALLIZZAZIONE DEL SOLFATO DI RAME
Lo scopo della esperienza è l'ossidazione del rame metallico per mezzo dell'acido solforico e cristallizzazione del solfato di rame formatosi.
Attrezzatura richiesta: Becker, bacchettino di vetro, imbuto, portaimbuto, piastra riscaldante, contagocce, pipetta graduata, cilindro graduato, carta da filtro, cristallizzatore, palla di peleo, vetrino di orologio.
Materiale richiesto: acqua distillata, rame metallico, 15 ml di una soluzione di H2SO4 conc. gocce di acido nitrico concentrato.
Procedimento:
Dopo aver pesato 3 gr. di Cu metallico per mezzo di una bilancia analitica, ho aggiunto al mio becker contenente i trucioli circa 10 ml di acqua distillata e sotto cappa, invece, utilizzando la pipetta graduata ho prelevato acido solforico concentrato facendo molto attenzione nel versarlo goccia a goccia al becker, poiché nel fare questo si sviluppa calore e la soluzione quindi si potrebbe riscaldare troppo. Ho portato il tutto al bancone in cui vi era la piastra riscaldante cha avevo inizialmente acceso, quindi ho poggiato il becker sulla piastra calda e ho aggiunto 3 gocce di acido nitrico per far partire la reazione. Ho cominciato ad agitare con il bacchettino di vetro portando ad ebollizione la soluzione.
E' noto che il rame riscaldato all'aria si trasforma in ossido rameico che a più alta temperatura, passa a rameoso. Viene attaccato facilmente dall'acido nitrico, ma non dal Cloridrico, l'acido solforico diluito non lo attacca e nemmeno l'acido solforico concentrato a temperatura ordinaria, bensì a temperature elevate (ecco perché bisogna portare la piastra a circa 250°C), svolgendo anidride solforosa. Il rame è un metallo rosso chiaro, duttile non viene attaccato dagli acidi che agiscono solo come tali ma da quelli che prima agiscono come ossidanti e poi salificano l'ossido formato:
Cu + H2SO4 CuO + SO2 + H2O CuO + H2SO4 CuSO4 + H2O
(mentre a più basse temperature e specialmente intorno ai 100°C si forma anche Cu2S
5Cu + H2SO4 H2O + Cu2S + 3CuO
quest'ultimo(CuO) si salifica facilmente con l'acido solforico concentrato in eccesso ma il solfuro si intacca difficilmente).
L'acido nitrico facilita la dissoluzione del rame.
Dall'espressione del potenziale ossido riduttivo relativo alla semi - reazione dello ione H+ (H3O+):
2H+ + 2e D H2(g)
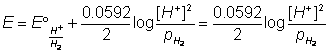
si ottiene (se l'H2 si libera all'atmosfera p(H2) =1.00 atm )
E = -0.0592 pH
Una soluzione di H+ 1.0 mol dm -3 (pH = 0, E=0.0 V) è in grado di comportarsi da ossidante solo rispetto a coppie ossido - riduttive che hanno potenziali più piccoli del suo cioè minori di zero (in modo quantitativo se il potenziale è inferiore a -0.300 V; a pH più alti H+ è meno ossidante
I "normali" metalli che hanno potenziale normale ossido riduttivo negativo come zinco e alluminio:
Zn2+ + 2eD Zn E° = -0.763 V
Al3+ + 3e D Al E° = -1.662 V
Possono essere ossidati dallo ione H+ di acidi minerali non ossidanti.
I metalli "nobili" invece hanno un potenziale ossido - riduttivo > 0:
Cu2+ + 2e D Cu E°=0.314 V
Ag+ + e D Ag E°=0.800 V
e richiedono un ossidante più energico di H+ quale può essere l'acido nitrico in ambiente acido.
Dalla espressione del potenziale della semireazione relativa alla riduzione dell' acido nitrico:
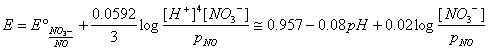
4H+
+ NO3- + 3e D NO(g) + 2H2O
si osserva che il potenziale aumenta col diminuire del pH. In altri termini all'aumentare dell'acidità il potere ossidante dell'acido nitrico aumenta.
Quindi è fondamentale per i motivi sopra indicati l'uso dell'acido nitrico per fare partire la reazione mentre un acido con potere ossidante inferiore rispetto a quello dell'acido nitrico non riuscirebbe ad ossidare il rame.
Completata la dissoluzione del rame abbiamo preparato un filtro per l'imbuto che abbiamo poggiato sull'apposito sostegno e al disotto del quale abbiamo posto il cristallizzatore. Abbiamo imbibito il filtro con acqua calda precedentemente preparata. Versando con un contagocce la soluzione di CuSO4 ci accorgiamo che il filtro utilizzato comincia a bucarsi, questo è dovuto al fatto che nella soluzione era presente ancora acido solforico, quindi abbiamo aggiunto altra acqua distillata e abbiamo ripetuto il filtraggio. Completata questa operazione abbiamo posto sulla piastra il cristallizzatore per riscaldarlo facendo svaporare la soluzione fino a renderla di colore molto intenso(blu).
![]() Infine lasciando riposare il tutto per 24 ore, coprendo con un vetrino
d'orologio, si formerà un solido cristallino (CuSO4 x 5H2O) che ha una
colorazione azzurra, questa colorazione è dovuta alla presenza dell'acqua, se
l'acqua viene allontanata dai cristalli si ottiene il solfato di rame anidro
che è praticamente bianco.
Infine lasciando riposare il tutto per 24 ore, coprendo con un vetrino
d'orologio, si formerà un solido cristallino (CuSO4 x 5H2O) che ha una
colorazione azzurra, questa colorazione è dovuta alla presenza dell'acqua, se
l'acqua viene allontanata dai cristalli si ottiene il solfato di rame anidro
che è praticamente bianco.
![]()
![]()
![]()
![]()
![]() HO H O OH
HO H O OH
![]()
![]() OH2
OH2
![]()
![]()
![]() Cu O S
Cu O S
![]()
![]()
![]()
![]()
![]() OH2
OH2
HO H O OH
Solfato di Rame pentaidrato
Conclusioni:
durante la prova svolta in laboratorio, abbiamo ottenuto un precipitato di colore nero che era CuO cioè l'ossido di rame, inoltre la colorazione iniziale (cioè prima che tutto il rame si sciogliesse ) della soluzione era verde.
L'obiettivo prefissato era di calcolare la resa in percento in peso rispetto al rame di partenza:
Quantità di prodotto effettivo
![]() Resa = x 100
Resa = x 100
Quantità di prodotto teorico
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025