|
|
| |
1 - GENERALITA'
La formulazione è espressa sempre attraverso la formula di struttura che può essere ridotta a formula razionale che evidenzia solo i legami fra gli atomi di carbonio.
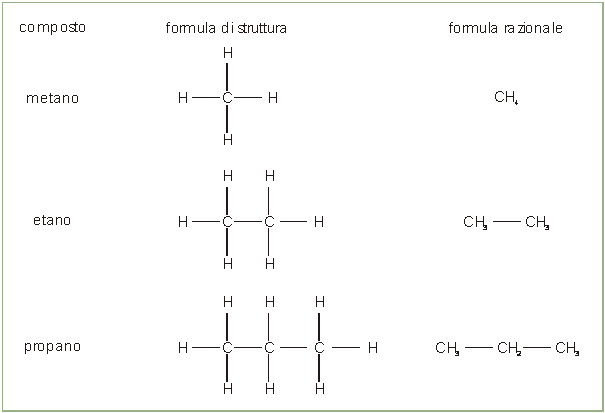
|
|
tutti gli atomi di C si trovano in uno stato di ibridazione tetragonale sp3 stabilendo: |
|
|
|
|
|
|
|
a) |
legami semplici σ covalenti omopolari con altri atomi di C |
|
|
b) |
legami semplici σ covalenti polari con gli atomi di idrogeno (più elettronegativo) generando una parziale carica negativa nelle adiacenze del C e positiva in quelle dell'H |
|
|
|
|
|
|
la formula generale è CnH2n+2 per cui ogni termine della serie, chiamato omologo, si ottiene dal termine che lo precede per aggiunta di un gruppo metilenico CH2 |
|
|
|
|
|
|
|
gli alcani hanno tutti desinenza -ano ed un prefisso che, dal quinto termine in poi (dopo metano - etano - propano - butano), deriva dalla numerazione greca o latina (pentano, esano, ecc) |
|
|
|
|
|
|
|
si definisce radicale alchilico un gruppo di atomi ottenuto da un alcano per rottura omolitica di un legame C - H |
|
|
|
|
|
|
|
la nomenclatura dei radicali alchilici è determinata dalle seguenti regole: |
|
|
|
|
|
|
|
a) |
si numera la sequenza carbonica più lunga e si dà il nome in base al numero di atomi di carbonio |
|
|
b) |
la numerazione ha inizio dall'estremità della catena più vicina alla ramificazione più semplice |
|
|
c) |
i radicali presenti nella catena vanno nominati o in ordine alfabetico o in ordine crescente della loro complessità |
|
|
d) |
per ogni radicale va specificata la posizione del carbonio a cui è legato |
|
|
e) |
per uno stesso radicale va precisato se si trova più volte nella molecola anteponendo il prefisso tri, tetra, ecc |
|
|
f) |
se uno stesso radicale è presente due volte sullo stesso carbonio, il numero d'ordine del carbonio stesso va ripetuto |
|
ALCANI |
RADICALI ALCANILICI |
|
metano CH4 |
metile CH3 - |
|
|
|
|
etano CH3 - CH3 |
etile CH3 - CH2 - |
|
|
|
|
propano CH3 - CH2 - CH3 |
propile CH3 - CH2 - CH2 - |
|
|
|
|
butano CH3 - CH2 - CH2 - CH3 |
butile CH3 - CH2 - CH2 - CH2 - |
|
|
|
|
pentano CH3 - CH2 - CH2 - CH2 - CH3 |
pentile CH3 - CH2 - CH2 - CH2 -CH2 - |
CH3
CH3 CH2 CH3
CH3 CH CH CH CH2 CH3
2 3 4 5 6
2,4-dimetil-3-etil-esano
CH3
CH2 CH3
CH3 CH CH2 CH CH CH2 CH CH3
7 6 5 4 3 2 1
CH2 CH3
CH3
2,4,7-trimetil-5-etil-nonano
2 - PROPRIETA' DEGLI ALCANI
Lo stato fisico degli alcani varia con l'aumentare del numero di atomi di carbonio (quindi del peso mole4colare) e della ramificazione delle catene ed in particolare:
a) la fase dei primi quattro termini è gassosa, quella dal quinto al quindicesimo è liquida e dal sedicesimo in poi è solida
b) sono insolubili in acqua e solubili in solventi non polari come l'etere ed il tetracloruro di carbonio
c) il punto di fusione, il punto di ebollizione e la densità aumentano con l'aumentare del numero degli atomi di carbonio
Le proprietà chimiche dipendono ovviamente dal particolare tipo di legame che è presente negli alcani e possono essere riassunte in:
sostituzione radicalica
combustione
cracking
|
1 - Sostituzione radicalica |
Consiste nella sostituzione di uno o più atomi di H con altri atomi, come per esempio (reazione di alogenazione) con gli alogeni che porta alla formazione degli alogenuri alchilici:
H H
H C H + Cl2 H C Cl + HCl monoclorometano
o cloruro di metile
H H
Gli alogenuri alchilici hanno formule generale R X (indicando con R il radicale alchilico e con X l'alogeno) e consentono la preparazione di molti derivati degli alcani, reagendo con una base di Lewis che presenta sempre almeno un doppietto elettronico non impiegato in legami.
Lo schema di reazione (sostituzione nucleofila) che si basa sulla rottura del legame R X è:
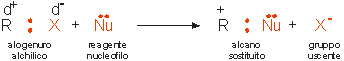
come mostrato anche nel seguente esempio:
H H
H C Cl + OH- H C OH + Cl- idrossido di metile
H H
|
2 - Combustione |
La combustione di un alcano si può schematizzare nel seguente modo:
CnH2n+2 + 0,5 (3n +1) O2 n CO2(g) + (n + 1) H2O(g) + Q
In cui si ha produzione, oltre che del calore Q essendo la reazione fortemente esotermica, anche di composti ossidati e fuliggine che concorrono non poco all'inquinamento atmosferico.
|
3 - Cracking |
La grande stabilità dei legami s rende necessaria una grande quantità di energia e l'impiego di catalizzatori quando occorre spezzare le lunghe catene idrocarburiche in frammenti più corti: tale risultato si ottiene attraverso il cracking che può essere distinto in:
a) cracking termico quando gli alcani si introducono in camere termiche a 600 °C ed altre nelle quali avvengono le rotture emolitiche dei legami C C ottenendo miscele di alcani a catena più corta, idrogeno ed alcheni a bassa massa molecolare;
b) cracking catalitico che viene impiegato per la produzione di combustibili a bassa massa molecolare in un processo che avviene a -400 °C e sotto leggera pressione con rottura eterolitica dei legami C C.
3 - PRINCIPALI METODI DI PREPARAZIONE DEGLI ALCANI
a) Idrogenazione catalitica degli alcheni e degli alchini
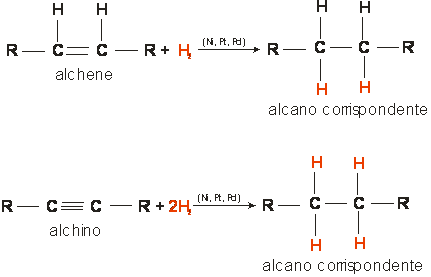
b) Riduzione di un alogenuro alchilico con un metallo e un acido
![]()
c) Idrolisi dei composti di Grignard
I composti di Grignard sono sostanze estremamente reattive con i composti inorganici (specie anidride carbonica e acqua) ma ancor più con tutti i composti organici generando prodotti misti organo-metallici del tipo R MgX (X = alogeno)
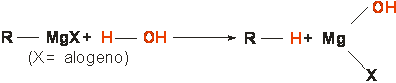
d) Sintesi di Wurtz
Si ottengono solo molecole con numero pari di atomi di carbonio e di lunghezza doppia di quella dell'alogenuro, utilizzando come metallo il sodio
![]()
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025