|
|
| |
Docente: Professoressa
Gruppo: 2
Argomento generale: cinetica chimica
Sottoargomenti e argomenti correlati:
velocità di reazione;
fattori influenzanti;
costante di Michaelis-Menten;
reazioni chimiche dirette e inverse;
equilibrio chimico dinamico(principio di Le Chatelier);
costante di equilibrio;
neutralizzazione;
coppie coniugate;
prodotto ionico dell'acqua;
pH;
molarità, molalità, normalità, grammoequivalenti, percentuale;
energia di attivazione;
calore di formazione e di combustione;
entalpia;
entropia;
energia libera.
Esperienze pratiche correlate (svolte in laboratorio):
Velocità delle reazioni chimiche;
Preparazione di una soluzione;
Uso degli indicatori e pH;
Equilibrio chimico.
Le strutture del mondo in cui viviamo, anche quelle che ci sembrano più stabili ed immutabili, sono il risultato di continue trasformazioni che producono uno stato di equilibrio. Esse sono studiate dalla cinetica chimica, che in particolare tratta della loro velocità e dei meccanismi con cui esse avvengono.
Per velocità di reazione si intende la trasformazione di reagenti in prodotti e viceversa e la variazione di concentrazione in una data soluzione nell'unità di tempo.
Inoltre in questa relazione cercheremo di illustrare i fattori che possono influenzare ogni reazione, l'energia presente nel sistema, la concentrazione di ioni H+ (fondamentali nella maggior parte delle trasformazioni inorganiche), reagenti e prodotti e i diversi 757j91h modi per misurarli. Al fine di comprendere questi concetti della chimica moderna, abbiamo integrato al nostro lavoro alcune esperienze svolte in laboratorio.
La velocità di reazione è il tempo in cui si formano i prodotti. Questa può variare da poche frazioni di secondo (nel caso di un'esplosione) a varie migliaia di anni (ad esempio la formazione del petrolio).
Quando ci si trova davanti ad una reazione, seppure bilanciata, per ottenere determinati prodotti in laboratorio, è necessario tenere conto delle concentrazioni dei reagenti e di ciò che si formerà una volta avvenuta. Per poter misurare le quantità, si può ricorrere a vari metodi, fra cui:
molarità: rapporto fra moli di soluto (sostanza presente in minore quantità) e volume della soluzione (n. moli di soluto / ml di soluzione * 1000); è il metodo più utilizzato e come unità di misura si utilizza il simbolo M.
molalità: rapporto fra moli di soluto e massa del solvente (sostanza presente in maggiore quantità) (n. moli soluto / g solvente * 1000), per rappresentarlo si utilizza il simbolo m.
normalità: rapporto fra moli equivalenti (ovvero n. moli / n. ioni H+ o OH-) e volume della soluzione (m. equivalente / ml soluzione * 1000); si indica con N.
percentuale: rapporto fra massa del soluto e massa della soluzione in percentuale ( g soluto / g soluzione * 1000); si indica con %.
pH: concentrazione di ioni H+ rilasciati da un acido o una base messi in acqua. I valori del pH sono stati catalogati in una scala da 1 a 14. Da 1 a 6 è un acido, in particolare da 1 a 3 è un acido forte (si dissocia totalmente), da 4 a 6 debole (ovvero rilascia solo parzialmente ioni H+ - si dissocia solo in parte). Il valore 7 indica una sostanza neutra (come l'acqua distillata o i sali). Da 8 a 14 è una base, di cui se è da 11 a 14 è forte (rilascia totalmente ioni OH- -si dissocia completamente), da 8 a 11 debole (rilascia solo parzialmente ioni OH- -si dissocia parzialmente).
Secondo la definizione del chimico Arrhenius, per acido si intende una sostanza formata da ioni idrogeno e che libera idrogenioni (H+) in soluzione acquosa; mentre per base invece s'intende una sostanza che libera ioni ossidrili (OH-) in soluzione acquosa).
Secondo invece Bronsted & Lowry un acido è un donatore di idrogenioni (ioni H+) e una base è un accettore di idrogenioni (H+).
Secondo Lewis si definisce acida qualsiasi specie chimica capace di legarsi a un doppietto elettronico non condiviso; mentre basica qualsiasi specie che ha un doppietto elettronico non condiviso.
A. Natura dei reagenti: a seconda della natura e della configurazione elettronica dei reagenti e del tipo di reazione può variare la velocità della stessa. Ad esempio in una reazione di formazione, che prevede uno scambio di elettroni, il passaggio da reagenti a prodotti avverrà piuttosto lentamente. Al contrario reazioni ioniche(di neutralizzazione e doppio scambio) avvengono pressoché istantaneamente poiché gli ioni di una carica attraggono quelli di carica opposta.
B. Concentrazione: la concentrazione è la quantità di materia in un'unità di volume. Perché una reazione abbia luogo, le particelle devono scontrarsi e se il numero di particelle per l'unità di volume aumenta è maggiore la probabilità che questo avvenga.
C. Temperatura: per formare legami e quindi per poter reagire, le molecole devono scontrarsi tra loro. La velocità di una reazione è determinata dalla frequenza di questi urti: secondo le leggi della cinetica infatti, la velocità(energia cinetica) delle molecole aumenta con l'aumentare delle collisioni.
D. Pressione: Analogamente alla temperatura, aumentando la pressione dei reagenti, si riduce la superficie di contatto tra le particelle, e quindi aumenta il numero di urti tra le stesse, accelerando la reazione.
E. Km Vmax V T (s)![]()
![]()
![]()
![]()
![]() Catalisi: Energia di attivazione è l'energia che è
necessario fornire per fare iniziare una reazione: questa può essere superata
anche impiegando alcune sostanze chiamate catalizzatori. Nel corso della
reazione il catalizzatore rimane chimicamente immutato ed esso interviene in
modo tale che l'energia risulti inferiore a quella della reazione non
catalizzata. Queste sostanze sono generalmente enzimi, particolari tipi di
proteine dotati di un sito - attivo con cui interagiscono con uno dei reagenti:
il complesso enzima - substrato assume una forma molecolare che reagisce meglio
con gli altri reagenti. Gli enzimi hanno un'alta specificità ossia riconoscono
solo il substrato adeguato( hanno un'alta efficienza ed efficacia): dopo che si
è legato, il substrato cambia la morfologia e l'enzima si stacca poiché non lo
riconosce più.
Catalisi: Energia di attivazione è l'energia che è
necessario fornire per fare iniziare una reazione: questa può essere superata
anche impiegando alcune sostanze chiamate catalizzatori. Nel corso della
reazione il catalizzatore rimane chimicamente immutato ed esso interviene in
modo tale che l'energia risulti inferiore a quella della reazione non
catalizzata. Queste sostanze sono generalmente enzimi, particolari tipi di
proteine dotati di un sito - attivo con cui interagiscono con uno dei reagenti:
il complesso enzima - substrato assume una forma molecolare che reagisce meglio
con gli altri reagenti. Gli enzimi hanno un'alta specificità ossia riconoscono
solo il substrato adeguato( hanno un'alta efficienza ed efficacia): dopo che si
è legato, il substrato cambia la morfologia e l'enzima si stacca poiché non lo
riconosce più.
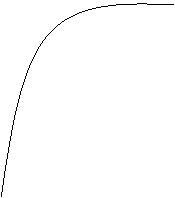
Riportando sul grafico V/T la velocità di una reazione si ottiene un ramo di parabola. La costante di Michaelis - Menten (Km) è quel valore che coincide con la metà della velocità massima della reazione stessa.
Km più basso è il valore di Km, e più specifico sarà il nostro enzima.
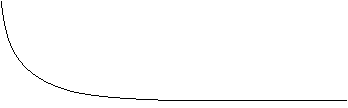
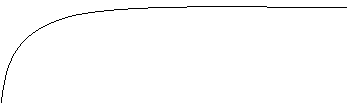
Equilibrio chimico Velocità della reazione diretta Velocità della reazione inversa V T (s)
![]()
![]() Una reazione solitamente
può avvenire sia direttamente, ossia da reagenti a prodotti, che per via
inversa. In realtà solo una su 554 x 106
molecole di prodotto si
ritrasforma in reagente. Quando le due reazioni hanno uguale velocità la
quantità di prodotti che si trasforma in reagenti è la stessa di quella dei
reagenti che si trasformano in prodotti. In un'unità di tempo t diminuirà la
velocità della reazione diretta perché diminuiranno i regenti, mentre aumenterà
quella dell'inversa in quanto aumenteranno i prodotti. L'equilibrio chimica si
ha quindi quando le due reazioni avvengono contemporaneamente: in questo caso
la reazione originale si dice reversibile.
Una reazione solitamente
può avvenire sia direttamente, ossia da reagenti a prodotti, che per via
inversa. In realtà solo una su 554 x 106
molecole di prodotto si
ritrasforma in reagente. Quando le due reazioni hanno uguale velocità la
quantità di prodotti che si trasforma in reagenti è la stessa di quella dei
reagenti che si trasformano in prodotti. In un'unità di tempo t diminuirà la
velocità della reazione diretta perché diminuiranno i regenti, mentre aumenterà
quella dell'inversa in quanto aumenteranno i prodotti. L'equilibrio chimica si
ha quindi quando le due reazioni avvengono contemporaneamente: in questo caso
la reazione originale si dice reversibile.
Se dall'esterno modifico certi parametri il sistema di reazione reagisce in modo contrario per ripristinare una nuova situazione di equilibrio. Si può intervenire sui fattori già incontrati per la velocità di reazione:
B. Temperatura
C. Natura dei reagenti
D. Concentrazione
La costante di equilibrio è un valore numerico che si ricava dal rapporto tra il prodotto delle concentrazioni dei prodotti ed il prodotto delle concentrazione dei reagenti, ciascuno elevato al suo coefficiente stechiometrico.
![]() aA+bB cC+dD
aA+bB cC+dD
[C]c x [D]d
![]() K =
K =
[A]a x [B]b
La costante ci indica dove si sposta l'equilibrio chimico:
K > 1 E' favorita la reazione diretta
K < 1 E' favorita la razione inversa
K = 1 L'equilibrio è raggiunto al 50%
Nel caso particolare dell'acqua il prodotto ionico è il prodotto tra le concentrazioni dell'idrogenione (ione idrogeno, H+)e dell'ossidrile(ione idrossido, OH- ) e risulta uguale al prodotto tra la concentrazione della molecola d'acqua e della sua costante d'equilibrio. Va notato però che ogni volta che l'acqua si dissocia si formano idrogenioni ed ossidrili di uguale concentrazione, quindi il prodotto ionico può essere anche inteso come il quadrato della concentrazione dello ione idrogeno.
![]() H2O H+
+ OH-
H2O H+
+ OH-
[H+] x [OH-]
[H2O]
ma [H+] = [OH-] [H+]2
Kw = [H+]2 = 10-14
In particolare:
Soluzione Acida |
Soluzione Neutra |
Soluzione Basica |
|
|
|
|
In una reazione vi sono continui scambi di energia, che permettono di formare e sciogliere legami chimici. In particolare sono molto importanti gli scambi di energia termica, definita come calore. In base a questo possiamo definire due categorie di reazione:
endotermica, se per avvenire è necessario fornire una certa quantità di energia termica, poiché Ereagenti < Eprodotti. Ad esempio H2+I2 + Energia 2 HI ;
esotermica, se quando avviene libera energia termica nel sistema, poiché Ereagenti > Eprodotti. Ad esempio CH4+2 O2 CO2 + 2 H2O + Energia.
Inoltre viene definito calore di reazione, quello che viene sviluppato, ceduto o acquistato durante una reazione. Va indicato con J (Joule, corrispondente a 4,186 calorie). Di questo possiamo distinguere in:
calore di formazione, cioè calore che viene ceduto o preso dall'esterno quando la reazione avviene, considerando come quantità quelle del suo bilanciamento;
calore di combustione, cioè calore che si sviluppa per ogni mole di prodotto.
Un esperimento che si può realizzare in laboratorio, per capire questi concetti o verificare se una reazione è endotermica o esotermica, è il seguente:
dopo aver disposto come nella figura sottostante, si misura la temperatura iniziale;
si fa avvenire una reazione all'interno della camera di reazione (o bomba calorimetrica), che è interamente immersa in un becker pieno d'acqua;
si misura nuovamente la temperatura: se è aumentata, la reazione è esotermica, poiché libera calore nel sistema; se è diminuita, la reazione è endotermica, poiché acquista calore dal sistema;
durante l'intera esperienza sarebbe opportuno utilizzare un agitatore che mantenga costante la temperatura dell'acqua in ogni punto dell'acqua.
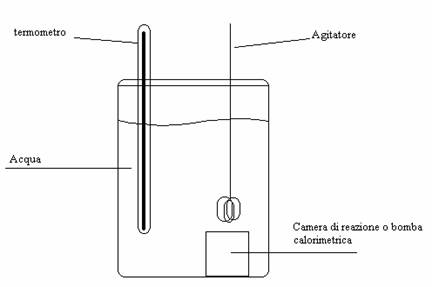
La formula per poter calcolare il calore è: Q (calore) = m (massa d'acqua) * (tfinale - tiniziale).
Il calore di reazione può dipendere dalla natura dei reagenti, dalle condizioni di pressione e di temperatura, dallo stato di aggregazione dei reagenti e dalle loro quantità impiegate.
Viene indicato con H il contenuto termico di una sostanza, ovvero "quanto calore può transitare in essa". È detta anche entalpia.
Se il DH < 0 (ovvero Efinale - Einiziale < 0) allora la reazione è detta esotermica e esoergonica.
Se il DH > 0 (ovvero Efinale - Einiziale > 0) allora la reazione è detta endotermica e endoergonica.
Il fatto che le reazioni chimiche siano accompagnate da emissione o assorbimento di calore porta ad ammettere che ogni sostanza possieda un proprio contenuto termico (per l'appunto l'entalpia, H). Considerando una reazione chimica generica (reagenti prodotti), ogni reagente e ogni prodotto ha il proprio H. Generalmente la somma dei contenuti termici dei reagenti è diversa dalla somma dei contenuti termici dei prodotti; quindi una reazione chimica è accompagnata da una variazione di contenuto termico (DH).
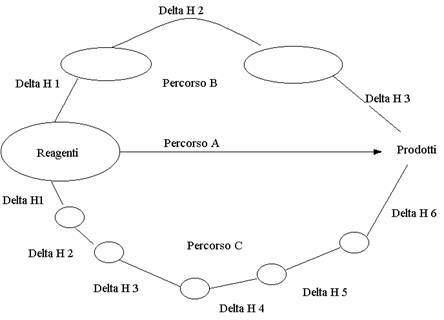
Legge di Hess
Una stessa reazione chimica può avvenire in un unico stadio (percorso A) o in diversi stadi, passando attraverso una serie di prodotti intermedi (percorsi B e C). La quantità di calore che si sviluppa (o viene assorbita) nel passaggio da reagenti a prodotti è la stessa, qualunque sia il percorso seguito dalla reazione. Quindi la somma dei DH (variazione dei contenuti termici) dei singoli stadi di un percorso a più stadi deve risultare uguale al DH che la reazione ha quando avviene in un unico stadio. Nell'esempio generico considerato nella figura sottostante, per il percorso B deve essere :
DH1+ DH2 +DH3 =DH
e per il percorso C deve essere DH1 + DH2 + DH3 + DH4+ DH5 + DH6 = DH
Parlando di reazioni chimiche, spesso si commette l'errore di credere queste come spontanee, ma in realtà in natura non tutte le reazioni possono essere considerate come spontanee. Per sapere quindi la natura del tipo di reazione che si va ad analizzare, bisogna tenere in considerazione la variazione di entropia universale che la accompagna, in altre parole il "livello di disordine dell'universo".
I chimici hanno perciò introdotto l'energia libera di Gibbs (prende il nome appunto dal chimico che l'ha scoperta), indicata con DG, definita come la differenza fra la variazione di entalpia e il prodotto della variazione di entropia per la temperatura del sistema misurata in gradi Kelvin: DG= DH (variazione di entalpia) - T*DS (variazione di entropia).
La variazione di energia libera del sistema è annessa quindi alla variazione di entropia e entalpia, e alla temperatura a cui la reazione avviene. Se DG < 0 allora la reazione è definita spontanea, poiché aumenta l'entropia; se DG > 0 invece è non spontanea, poiché diminuisce l'entropia. I valori di H e S per sono stati determinati per molte sostanze e riportati in apposite tabelle.
Un fenomeno viene definito spontaneo se non intervengono forze esterne al sistema e se implica un aumento di entropia universale.
Per capire e comprendere in maniera più approfondita che cosa sono le reazioni di ossido-riduzione possiamo fare riferimento all'esperienza di laboratorio "reazioni di ossido-riduzione", il cui scopo è verificare i quattro stati del manganese. Per cominciare, nel Permanganato di Potassio (KMnO4), il Mn ha come stato di ossidazione +7, perciò la sostanza avrà il colore naturale, ovvero rosso-violetto. In un'altra provetta si aggiungerà a KMnO4 una soluzione goccia a goccia di Na2S2O5 e si noterà un cambiamento di colore dal violetto all'incolore, prova che il Mn ha cambiato stato, acquistando cinque elettroni e quindi ha come nuovo numero di ossidazione +2. I cinque elettroni vengono "persi" dalla soluzione di Na2S2O5 e più precisamente dallo Zolfo che passa da +5 a +6, ovviamente bilanciando si avrà come coefficiente stechiometrico cinque. Così si farà per gli altri due stati di ossidazione del Manganese. La conclusione che si può trarre è che in un'ossido-riduzione vi è un elemento che si riduce (il suo numero di ossidazione diminuisce e quindi acquista elettroni) e uno che si ossida (il suo numero di ossidazione aumenta e quindi libera elettroni), ricordando che il numero di elettroni persi deve essere uguale al numero di quelli acquistati.
Alcune reazioni presentano una curiosa particolarità: alcune si riscaldano, altre si raffreddano. ma perché avviene questo? Esistono reazioni che per avvenire hanno bisogno di liberare calore o di assorbirlo dall'esterno. Le reazioni che cedono calore, ovvero si "riscaldano" (anche perché hanno un DT > 0) vengono chiamate esotermiche (cfr. "Il calore") o esoergoniche, poiché liberano anche energia in forma di calore. Quelle che si "raffreddano" invece vengono chiamate endotermiche (cfr. "Il calore") o endoergoniche, poiché hanno DT < 0 e hanno quindi assorbito energia sotto forma di calore. Anche nell'esperienza "Aspetti energetici nelle reazioni chimiche", si sono fatte reagire alcune sostanze che liberano o assorbono calore dall'ambiente.
Queste reazioni però possono avvenire in tempi diversi. Per verificare questo fenomeno si hanno a disposizione tre esperienze possibili, tutte e tre trattano della velocità di reazione, ma si differenziano per il loro scopo. Due di esse hanno per scopo capire l'influenza della temperatura, della concentrazione, dei catalizzatori, della superficie di contatto e naturalmente della natura dei reagenti sulla velocità delle reazioni (cfr. paragrafo La velocità delle reazioni). L'esperienza avviene facendo reagire due sostanze diverse, misurando il tempo che occorre alla reazione per avvenire e calcolandone la velocità (D m / D t). L'altra esperienza si basa solo sulla velocità delle reazioni in generale, senza considerare tutti gli aspetti che posso modificare il tempo in cui essa avviene. Il tempo, infatti, può variare moltissimo, come lo dimostra il fatto che reazioni che ci metterebbero ore o addirittura giorni è possibile farle avvenire nel giro di pochi minuti, grazie appunto ad alcuni accorgimenti sperimentali.
Molte di queste reazioni avvengono in soluzione (per soluzione si intende un miscuglio omogeneo, ovvero quando non si riconoscono più diversi reagenti e quando non vi è la stessa concentrazione degli stessi nelle varie parti della soluzione). Le soluzioni vengono preparate in laboratorio, come viene spiegato nell'esperienza dal titolo "Preparazione di una soluzione". Fra i vari scopi vi è anche quello di raggiungere la concentrazione in percentuale o in molarità richiesta, tramite l'aumento o la diminuzione del volume della soluzione.
Le soluzioni possono essere acide o basiche. In un'esperienza di laboratorio dal titolo "Il pH", si utilizzano i tre metodi per verificare il pH di una soluzione: cartina tornasole, indicatore universale, ph-metro. Alcune sostanze rilasciano ioni H+ o OH- a contatto con l'acqua: se la concentrazione di ioni H+ è maggiore di quelli OH- la sostanza è acida; se è minore è basica e se è uguale è neutra.
Vi è inoltre un'altra esperienza simile, in cui s utilizzano i tre metodi per verificare l'acidità o la basicità della soluzione presa in considerazione.
Tutte le esperienze citate sono state allegate alla relazione.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2026