|
|
| |
TRASFORMAZIONI DEI GAS
Nella dilatazione termica dei solidi e dei liquidi si tiene conto di due sole grandezze: il volume e la temperatura. Una terza grandezza, la pressione, viene trascurata; ciò perché 515d34f la sua influenza sul volume di un solido o di un liquido è da ritenersi praticamente irrilevante.
Non altrettanto si può però dire per gli aeriformi, il volume dei quali è largamente influenzato dalla pressione, oltre che dalla temperatura.
Sono quindi tre la grandezze che definiscono lo stato fisico di un aeriforme: la temperatura, la pressione, il volume.
Si dice che un aeriforme subisce una trasformazione se cambia il valore di almeno due di tali grandezze.
Trasformazione isoterma: se variano pressione e volume, mentre la temperatura si mantiene costante.
Trasformazione isobara: se variano temperatura e volume, mentre la pressione si mantiene costante.
Trasformazione isocora: se variano temperatura e pressione, mentre il volume si mantiene costante.
In un quarto tipo di trasformazione detta adiabatica variano tutte e tre le grandezze.
TRASFORMAZIONI ISOTERME - LEGGE DI BOYLE
Le trasformazioni isoterme sono regolate dalla legge di Boyle.
"A temperatura costante una data quantità di gas occupa un volume che è inversamente proporzionale alla pressione che su di esso viene esercitata".
Questa legge si può anche esprimere dicendo che: "A una data temperatura il prodotto della pressione per il volume è una costante (P.V=k)". Tale legge è una legge limite, valida pienamente solo per un gas ideale e in pratica per un gas lontano dal punto di liquefazione e sottoposto ad una pressione non molto elevata; nel caso di un gas reale quindi, è necessario introdurre opportune correzioni che ne riconducano il comportamento a quello di un gas ideale.
t = costante p · v = k
![]()
![]()
![]()
![]()
![]() p (pressione), v (volume) e t
(temperatura)
p (pressione), v (volume) e t
(temperatura)
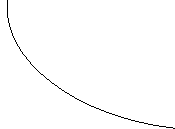
La legge di Boyle è rappresentata graficamente da una curva detta iperbole.
p
![]()
![]()
v
TRASFORMAZIONI ISOBARE - PRIMA LEGGE DI GAY-LUSSAC
Se la temperatura di un aeriforme varia a pressione costante, si ha come conseguenza una variazione di volume, la quale è regolata dalla legge per la dilatazione termica. Per gli aeriformi perfetti, il coefficiente di dilatazione termica a pressione costante () non dipende dalla loro natura, ma è sempre uguale a 1/273=0,003663.
Quindi possiamo scrivere la legge per la dilatazione termica nel seguente modo:
Vt = Vo (1 + t)
ovvero:
Vt = Vo (1 + 1/273t)
la quale esprime matematicamente la prima legge di Gay-Lussac:
le variazioni di volume di un aeriforme perfetto, provocate da variazioni di temperatura a pressione costante, sono direttamente proporzionali al volume a 0°C e alle variazioni di temperatura, ma non dipendono dalla natura dell'aeriforme.
p = costante v/t = k
In una trasformazione isobara all'aumentare della temperatura t aumenta anche il volume v
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() P
P
![]()
![]()
p
![]()
![]()
Se passo dallo stato 1 con V1 T1 allo stato 2 con V2 T2 si ha:
V1/ T1 = V2/ T2
![]()
V1 V2 v
TRASFORMAZIONI ISOCORE - SECONDA LEGGE DI GAY-LUSSAC
Se si opera in modo da mantenere costante il volume di una massa aeriforme, variando la temperatura si verificano variazioni della pressione. Tale trasformazione è regolata dalla seconda legge di Gay-Lussac:
le variazioni di pressione di un aeriforme perfetto, provocate da variazioni di temperatura a volume costante, sono direttamente proporzionali alla pressione a 0°C e alle variazioni di temperatura, ma non dipendono dalla natura dell'aeriforme.
L'espressione matematica di tale legge è la seguente:
pt = po (1 + at)
Il valore di a è sempre 1/273, qualunque sia la natura dell'aeriforme. L'equazione si può quindi scrivere:
pt = po (1 + 1/273t)
v = costante p/t = k
In una trasformazione isocora pressione p e temperatura t sono direttamente proporzionali

![]() Pistone bloccato
Pistone bloccato
![]()
![]()
![]() p
p

Se passo dallo stato 1 con P1 T1 allo stato 2 con P2 T2 si ha:
P1/ T1 = P2/ T2
![]()
![]() P1
P1
![]()
V v
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025