|
|
| |
RELAZIONE SULLA SECONDA ESPERIENZA DI
CHIMICA 1 E LABORATORIO
ESERCIZIO N° 1 (TITOLAZIONE VOLUMETRICA ACIDO FORTE - BASE FORTE CON USO DI INDICATORE):
Prima
di iniziare l'esperienza, ci è stata consegnata una soluzione di HCl avente
titolo (o concentrazione) incognita (![]() ). Si avvina la buretta di sinistra
con l'aggiunta di una minima quantità di soluzione di NaOH 0,1 M; si carica con
quest'ultima soluzione e si legge il volume iniziale (per convenienza si è
partiti da 0 ml). Si avvina la buretta di destra con l'aggiunta della soluzione
di HCl a titolo incognito e si carica con quest'ultima soluzione; si legge il
volume iniziale (per convenienza si è partiti da 0 ml). Si trasferisce dalla
buretta in un beaker da 250 ml un volume noto (circa 15 ml) della soluzione di
HCl; tale soluzione viene diluita con 60 ml di acqua distillata (misurata con
l'ausilio di un cilindro graduato) per facilitare l'analisi della titolazione. 313h75d
Si aggiungono due gocce di indicatore Fenoftaleina, il quale cambia colore nel
punto di equivalenza, dove la quantità di titolante aggiunto è
stechiometricamente eguale alla quantità di sostanza analizzata, della
soluzione. Si mescola accuratamente la soluzione e si posiziona il beaker al di
sotto della buretta contenente la soluzione di NaOH. Si comincia a titolare la
soluzione di acido aggiungendo goccia a goccia la soluzione di NaOH (agitando
accuratamente la soluzione) e rallentando l'erogazione quando si comincia ad
ottenere una colorazione rosa pallido nel punto di caduta della goccia. Si
annota per ogni variazione di colorazione il valore di volume aggiunto. Il
punto di equivalenza è raggiunto quando, dopo l'aggiunta di una goccia di
titolante, la soluzione si colora di rosa pallido per almeno 40 secondi (PUNTO
DI VIRAGGIO). Si annota il volume di NaOH a cui si è verificato il punto di
equivalenza. A questo punto, si può calcolare il titolo incognito della soluzione di HCl:
). Si avvina la buretta di sinistra
con l'aggiunta di una minima quantità di soluzione di NaOH 0,1 M; si carica con
quest'ultima soluzione e si legge il volume iniziale (per convenienza si è
partiti da 0 ml). Si avvina la buretta di destra con l'aggiunta della soluzione
di HCl a titolo incognito e si carica con quest'ultima soluzione; si legge il
volume iniziale (per convenienza si è partiti da 0 ml). Si trasferisce dalla
buretta in un beaker da 250 ml un volume noto (circa 15 ml) della soluzione di
HCl; tale soluzione viene diluita con 60 ml di acqua distillata (misurata con
l'ausilio di un cilindro graduato) per facilitare l'analisi della titolazione. 313h75d
Si aggiungono due gocce di indicatore Fenoftaleina, il quale cambia colore nel
punto di equivalenza, dove la quantità di titolante aggiunto è
stechiometricamente eguale alla quantità di sostanza analizzata, della
soluzione. Si mescola accuratamente la soluzione e si posiziona il beaker al di
sotto della buretta contenente la soluzione di NaOH. Si comincia a titolare la
soluzione di acido aggiungendo goccia a goccia la soluzione di NaOH (agitando
accuratamente la soluzione) e rallentando l'erogazione quando si comincia ad
ottenere una colorazione rosa pallido nel punto di caduta della goccia. Si
annota per ogni variazione di colorazione il valore di volume aggiunto. Il
punto di equivalenza è raggiunto quando, dopo l'aggiunta di una goccia di
titolante, la soluzione si colora di rosa pallido per almeno 40 secondi (PUNTO
DI VIRAGGIO). Si annota il volume di NaOH a cui si è verificato il punto di
equivalenza. A questo punto, si può calcolare il titolo incognito della soluzione di HCl:
![]()
![]()
ESERCIZIO N° 2 (TITOLAZIONE VOLUMETRICA ACIDO FORTE - BASE FORTE CON USO DI INDICATORE):
Si avvina la buretta di sinistra di soluzione di NaOH 0,1 M; si carica con quest'ultima soluzione e si legge il volume iniziale (per convenienza si è partiti da 0 ml). Si avvina la buretta di destra della soluzione di HCl a titolo incognito e si carica con quest'ultima soluzione; si legge il volume iniziale (per convenienza si è partiti da 0 ml). Si trasferisce dalla buretta in un beaker da 250 ml un volume noto (circa 15 ml) della soluzione di HCl; tale soluzione viene diluita con 60 ml di acqua distillata (misurata con l'ausilio di un cilindro graduato) per facilitare l'analisi della titolazione. 313h75d Si aggiungono due gocce di indicatore Blu di Bromotimolo, il quale, al punto di viraggio, fa passare la soluzione da un colore giallo paglierino a celeste. Si mescola accuratamente la soluzione e si posiziona il beaker al di sotto della buretta contenente la soluzione di NaOH. Si comincia a titolare la soluzione di acido aggiungendo goccia a goccia la soluzione di NaOH (agitando accuratamente la soluzione) e rallentando l'erogazione quando si comincia ad ottenere una colorazione celeste nel punto di caduta della goccia. Si annota per ogni variazione di colorazione il valore di volume aggiunto. Il punto di equivalenza è raggiunto quando, dopo l'aggiunta di una goccia di titolante, la soluzione si colora di celeste per almeno 40 secondi. Si annota il volume di NaOH a cui si è verificato il punto di equivalenza. A questo punto, si può calcolare il titolo incognito della soluzione di HCl:
![]()
![]()
ESERCIZIO N° 3 (TITOLAZIONE VOLUMETRICA ACIDO FORTE - BASE FORTE CON USO DI pHMETRO):
Si carica la buretta di sinistra di una soluzione di NaOH 0,1 M e si legge il volume iniziale (per convenienza si è partiti da 0 ml). Si carica la buretta di destra della soluzione di HCl a titolo incognito e si legge il volume iniziale (per convenienza si è partiti da 0 ml). Si trasferisce dalla buretta in un beaker da 250 ml un volume noto (circa 15 ml) della soluzione di HCl; tale soluzione viene diluita con 60 ml di acqua distillata (misurata con l'ausilio di un cilindro graduato) per facilitare l'analisi della titolazione. 313h75d Si mescola accuratamente la soluzione e si posiziona il beaker al di sotto della buretta contenente la soluzione di NaOH. Si immergono gli elettrodi del pHmetro nella soluzione e si misura il pH iniziale di quest'ultima. Si comincia a titolare la soluzione di acido con aggiunte di circa 0,5 ml di soluzione di NaOH per volta (agitando accuratamente la soluzione) e si misura il pH per ogni aggiunta di titolante annotando in una tabella tale valore ed il corrispondente volume complessivo aggiunto. Si diminuisce progressivamente sino a 0,2 ml l'aggiunta di titolante man mano che ci si avvicina al punto di equivalenza. Si continua a titolare ed ad annotare i valori di pH corrispondenti al volume aggiunto nella tabella anche una volta superato il punto di equivalenza; a questo punto, si determina tale punto costruendo:
|
V (ml) |
pH |
|
V (ml) |
pH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
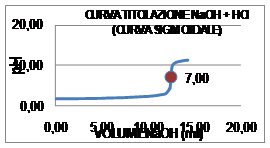
La Curva di titolazione (Curva Sigmoidale) di Acido Forte - Base Forte ponendo in ascissa i valori di volume ed in ordinata i corrispondenti valori di pH; in esso, il punto di equivalenza corrisponde al punto di flesso della curva:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
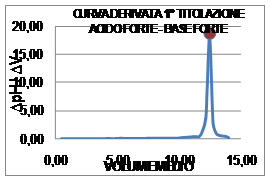
il Diagramma di tale
titolazione ponendo in ascissa il volume medio (![]() ) ed in ordinata il rapporto
) ed in ordinata il rapporto ![]() ; il punto di massimo della curva della derivata I° corrisponde al
punto di flesso della precedente curva:
; il punto di massimo della curva della derivata I° corrisponde al
punto di flesso della precedente curva:
Sperimentalmente si ricava che il punto di equivalenza si ha quando 12,45 ml di NaOH si aggiungono alla soluzione di HCl incognita ottenendo un pH = 7; da qui si ricava che la concentrazione di HCl è 0,08 M:
![]()
![]()
Tale titolazione presenta una reazione di questo tipo:
![]()
cioè è una semplice reazione di neutralizzazione dove inizialmente (cioè quando si è lontani dal punto di equivalenza) si ha una soluzione acida; nel punto di equivalenza, è neutra; oltre tale punto, la soluzione risulta basica.
ESERCIZIO N° 4 (TITOLAZIONE VOLUMETRICA ACIDO DEBOLE - BASE FORTE CON USO DI pHMETRO):
Si procede nel medesimo modo
dell'esercizio precedente solamente che invece della soluzione di HCl, si
prende una soluzione di ![]() (acido debole) a titolo ignoto; a questo punto, si determina tale
punto costruendo:
(acido debole) a titolo ignoto; a questo punto, si determina tale
punto costruendo:
|
V (ml) |
pH |
|
V (ml) |
pH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
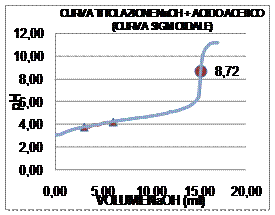
la Curva di titolazione (Curva Sigmoidale) di Acido Debole - Base Forte ponendo
in ascissa i valori di volume ed in ordinata i corrispondenti valori di pH; in esso, il
punto di equivalenza corrisponde al punto di flesso della curva:
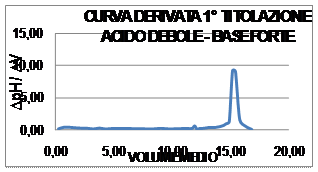
il Diagramma di tale titolazione ponendo in ascissa il volume
medio (![]() ) ed in ordinata il rapporto
) ed in ordinata il rapporto ![]() ; il punto di massimo della curva della derivata I° corrisponde al
punto di flesso della precedente curva:
; il punto di massimo della curva della derivata I° corrisponde al
punto di flesso della precedente curva:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sperimentalmente si ricava sia la concentrazione che il pH al punto di equivalenza:
![]()
Per misurare la
concentrazione di ![]() , si ha che:
, si ha che:
![]()
![]()
In tale titolazione si ha che:
all'inizio, si ha solamente una soluzione di acido debole così il pH è:
![]()
dopo l'aggiunta di una quantità inferiore all'equivalenza di titolante, la soluzione è formata da una serie di tamponi, così il pH è:
![]()
al punto di equivalenza si ha:
![]()
![]()
![]()
![]()
oltre il punto di equivalenza, la soluzione è formata da un
eccesso di ![]() ed il ph si ricava dal pOH.
ed il ph si ricava dal pOH.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025