|
|
| |
LEGAME CHIMICO
Raramente gli atomi si trovano isolati in natura, più di frequente essi si aggregano dando luogo a quella miriade di composti che caratterizza il mondo che ci circonda.
La scoperta della struttura elettronica dell'atomo ha permesso sia di capire quale doveva essere la natura delle forze che tengono unite fra di loro queste particelle elementari, sia di spiegare i modi diversi con cui si possono formare i legami chimici. Tali modelli consentirono successivamente anche di giustificare in modo coerente la costituzione della materia e di intuire il meccanismo che sta alla base dei processi chimici di trasformazione.
Prima di descrivere i vari tipi di legame chimico, è bene ricordare quella legge fondamentale di natura secondo la quale i sistemi materiali tendono spontaneamente a realizzare la condizione di minimo contenuto energetico. Questa legge vale anche per gli atomi che si aggregano per formare molecole, e quindi possiamo dire che due o più atomi tendono ad unirsi in quanto il contenuto energetico del composto finale risulta inferiore a quello degli atomi di partenza. Possiamo schematizzare il processo di formazione di un composto, nel modo seguente:
![]() &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; A
+ B AB + energia
&n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; A
+ B AB + energia
dove con A e B sono indicati due singoli atomi separati, e con AB il composto derivato dalla loro unione. La formazione di un legame chimico corrisponde quindi ad un bilancio energetico favorevole e l'esperienza insegna che quanto più alta è l'energia che si libera durante il processo, tanto più stabile risulterà il composto finale.
La tendenza degli atomi a formare fra loro i legami chimici è dovuta alle proprietà particolari dei loro elettroni. Gli elettroni non orbitano attorno al nucleo in modo causale, ma si dispongono su strati ben precisi, detti livelli energetici.
Quando un livello è pieno, gli elettroni devono occupare quello successivo, finchè tutti trovano il loro posto. Un atomo con l'ultimo livello energetico completo è particolarmente stabile e poco reattivo.
Ciò si verifica solo nei gas nobili, i pochi elementi che non formano legami. In un primo tempo non si riusciva a capire il motivo di tale inerzia chimica, ma, dopo che fu ideato il modello atomico, si notò che tutti i gas nobili (ad eccezione dell'elio) presentavano otto elettroni nell'ultimo livello quantico. Era logico pertanto concludere che la struttura elettronica ad otto elettroni sul livello energetico più esterno doveva rappresentare una condizione di particolare stabilità.
Tutti gli altri atomi devono collaborare tra loro scambiandosi e prestandosi alcuni dei loro elettroni, i cosiddetti elettroni di valenza, affinche l' ultimo livello energetico sia completo. Questo e' il principio del legame chimico.
Nel 1916, il chimico americano Gilbert Newton Lewis, suggerì un'ipotesi, che oggi va sotto il nome "regola dell'ottetto" per spiegare la tendenza che hanno gli atomi ad unirsi in composti. La regola può essere espressa nei seguenti termini: "Tutti gli atomi tendono a realizzare, sull'ultimo livello energetico, una configurazione ad otto elettroni, o singolarmente, o combinandosi."
A quel punto era chiaro che i modi diversi con cui gli atomi potevano legarsi per formare composti chimici, dipendevano dalla loro particolare configurazione elettronica esterna.
Oggi si definisce valenza di un elemento il numero degli elettroni spaiati che compaiono sull'ultimo livello quantico del corrispondente atomo. Elettroni di valenza sono gli elettroni dei livelli più esterni che partecipano alla formazione dei legami con altri atomi e conferiscono a ciascun elemento le sue peculiari proprietà chimiche. Ricordate che il numero degli elettroni di valenza di un elemento è uguale al numero del gruppo a cui appartiene (per gli elementi dei blocchi s e p).
L'idrogeno, ad esempio, che presenta l'atomo con un unico elettrone (ovviamente spaiato) sul primo livello energetico, è un elemento monovalente. Anche il sodio, il cui atomo possiede complessivamente undici elettroni, ma che nell'ultimo livello quantico ne presenta uno solo, è un elemento monovalente. Il carbonio, con due elettroni spaiati, presenta valenza base 2, mentre calcio e neon che non possiedono elettroni spaiati, devono essere considerati zerovalenti.
Si osservi che in alcuni casi, il valore della valenza secondo la nuova definizione, coincide con quello che avevano stabilito, in modo empirico, i primi chimici. Vi sono casi, però, in cui tale valore è diverso. Il calcio, ad esempio, forma svariati composti per cui non è ammissibile che la sua valenza possa essere zero.
In realtà, la valenza che abbiamo indicato come il numero degli elettroni spaiati dell'ultimo livello quantico dell'atomo, è solo una valenza base che può essere modificata spostando alcuni elettroni su altri orbitali vuoti disponibili. Nel calcio, ad esempio, è sufficiente un minimo apporto di energia, per elevare l'orbitale 4s, allo stesso livello energetico degli orbitali 4p vuoti. Avendo ora i quattro orbitali la stessa energia, in accordo con la regola di Hund ("gli elettroni hanno tendenza ad occupare il massimo numero possibile di orbitali con la stessa energia"), un elettrone dell'orbitale 4s deve andare ad occupare un orbitale 4p.
Il calcio passa quindi da valenza zero a valenza due, e il suo atomo viene detto "atomo eccitato". Analogamente, eccitando il carbonio, dalla bivalenza si passa alla tetravalenza secondo un meccanismo analogo a quello precedente.
Lo spostamento degli orbitali, e conseguentemente degli elettroni, avviene normalmente solo se è necessaria una minima spesa energetica. L'energia che bisogna fornire per spostare l'elettrone da un orbitale ad un altro, verrà successivamente restituita, e in misura ancora maggiore, in seguito alla formazione del legame.
Nel neon, invece, non essendoci a disposizione orbitali vuoti con energia di poco superiore a quella degli orbitali occupati dagli elettroni, servirebbe una notevole quantità di energia per innalzare questi ai livelli energetici molto alti degli orbitali vuoti. Ma questa energia non è disponibile nelle normali reazioni chimiche: il neon resta quindi zerovalente, e non dà composti.
Svariati sono i tipi di legami chimici; esistono infatti non solo legami fra atomi, ma anche fra ioni e fra molecole.
Legami intramolecolari
Sono i legami che si formano tra atomi. Si hanno:
LEGAME IONICO
Quando fra due atomi di specie diversa vi è una notevole differenza di elettronegatività (superiore a 1,8) si verifica il trasferimento in via definitiva di uno o più elettroni da un atomo all'altro, con formazione di uno ione positivo e di uno ione negativo. Gli ioni di segno opposto si attraggono tra loro formando un legame che prende il nome di legame ionico .
L'esempio più tipico di legame ionico è quello che si instaura fra cloro e sodio nel composto cloruro di sodio. Il sodio è un elemento del primo gruppo del Sistema Periodico cui compete un valore di elettronegatività pari a 0,9, mentre il cloro appartiene al settimo gruppo e ha valore di elettronegatività uguale a 3,0.
Poiché fra i due atomi vi è una notevole differenza di elettronegatività (2,1), avviene che il sodio ceda l'unico elettrone dell'ultimo livello quantico al cloro. In questo modo l'atomo, avendo perso un elettrone, diviene ione positivo Na+ ed assume la configurazione elettronica del neon, il gas inerte che si trova, all'interno del Sistema Periodico, nella casella precedente a quella del sodio. D'altra parte il cloro che possiede sette elettroni sull'ultimo livello energetico, assumendo l'elettrone dal sodio, diventa ione negativo Cl- con una configurazione elettronica identica a quella dell'argo, l'elemento che segue di un posto il cloro nel Sistema Periodico.
I due ioni Na+ e Cl- sono in realtà due strutture chimiche inerti simili a quelle dei gas nobili, perché possiedono la configurazione elettronica esterna ad otto elettroni. Tuttavia essi non sono più elettricamente neutri in quanto il numero di cariche positive del nucleo non è bilanciato da un eguale numero di cariche negative degli elettroni. I due ioni di segno opposto quindi si attraggono a causa della forza elettrostatica che si è instaurata fra essi.
E' opportuno specificare che con il legame ionico non si formano molecole: una molecola infatti è un aggregato di atomi e non di ioni. La formula di un composto ionico, ad esempio NaCl, non sta quindi ad indicare una molecola, ma semplicemente il rapporto numerico esistente nella struttura cristallina che la caratterizza fra gli ioni Na+ e gli ioni Cl-. La struttura cristallina del cloruro di sodio deve essere immaginata come una costruzione in cui ciascun ione Na+ è circondato da sei ioni Cl- e viceversa.
Il legame ionico è in genere un legame forte, ed è tanto più forte quanto maggiore è la carica elettrica posseduta dagli ioni coinvolti, e quanto minore è la distanza fra essi. La distanza fra gli ioni è determinata a sua volta dalle loro dimensioni.
Le proprietà dei
composti ionici sono legate al modo con cui gli ioni si legano.
I composti ionici sono solidi a temperatura ambiente, molto resistenti alla
compressione ma non alla trazione. Non sono conduttori di elettricità in quanto
le cariche elettriche (gli ioni) sono bloccati nel reticolo cristallino. Ma se
vengono sciolti in acqua, liberano gli ioni e la soluzione diventa conduttrice
(viene chiamata soluzione elettrolitica ogni soluzione in cui siano sciolti dei
sali).
LEGAME COVALENTE
Atomi in cui la differenza di elettronegatività non è cosi alta da permettere un legame ionico, completano l'ultimo livello senza ne' cedere ne' acquistare elettroni, ma mettendoli in comune con atomi dello stesso tipo o di tipo diverso, in modo tale che la molecola risulterà formata da atomi che hanno completato l'ultimo livello. Gli elettroni esterni che partecipano al legame si chiamano elettroni di valenza. Per esempio, due atomi di idrogeno, ognuno con valenza uno, possono combinarsi per formare la molecola biatomica di idrogeno, mettendo in compartecipazione due elettroni. Un legame di questo tipo è più forte del legame ionico visto in precedenza. All'interno di questa categoria di legami la forza aumenta all'aumentare del numero di coppie di legame esistenti tra i due elementi. Si divide:
- &n 515j99f bsp; LEGAME COVALENTE PURO
In generale, il legame che si forma in conseguenza della condivisione di elettroni fra due atomi qualsiasi, si chiama legame covalente. Se, in particolare, i due atomi che si uniscono sono della stessa specie, il legame prende il nome di covalente puro.
Quando due atomi di idrogeno si avvicinano l'uno all'altro (v. fig. 3), vi è un momento in cui l'elettrone di un atomo comincia a risentire, oltre che dell'attrazione del proprio protone, anche di quella del protone dell'atomo che gli sta a fianco, e viceversa. La nuvola elettronica che prima si trovava simmetricamente distribuita intorno a ciascun nucleo, ora si comincia a spostare nella zona compresa fra i due, in quanto, a mano a mano che gli atomi si avvicinano, la probabilità di trovare gli elettroni in prossimità dell'uno o dell'altro nucleo va aumentando. Esiste una distanza precisa (0,75 Å nel caso dell'idrogeno) fra i nuclei dei due atomi, in cui si ha il bilanciamento perfetto fra attrazioni e repulsioni: questa distanza è detta "lunghezza di legame" (o distanza di legame). I due elettroni della molecola H2 si muovono ora entro una regione di spazio che prende il nome di orbitale molecolare e può considerarsi il prodotto della fusione dei due orbitali atomici preesistenti. La struttura così raggiunta è stabile come lo è quella dell'atomo di elio.
La molecola di cloro, Cl2, si forma in modo analogo a quello descritto per l'idrogeno. In questo caso, però, la distribuzione elettronica esterna è diversa. Nel cloro, gli elettroni del livello energetico più esterno sono sette: di questi uno solo è spaiato e si trova in un orbitale di tipo p. Per ottenere la configurazione elettronica stabile ad otto elettroni, due atomi di cloro condividono i due elettroni spaiati dei rispettivi orbitali p.
Esistono alcune molecole semplici nelle quali fra i due atomi viene condivisa più di una coppia di elettroni. Una di queste è la molecola N2 dell'azoto. I tre elettroni spaiati si trovano su altrettanti orbitali di tipo p i quali sono disposti nello spazio a 90° fra di loro secondo le direzioni di una terna di assi cartesiani. Quando i due atomi di azoto si avvicinano, i tre orbitali di tipo p dell'uno si sovrappongono ai tre orbitali p dell'altro così che ciascun atomo di azoto condivide tre elettroni propri con i tre elettroni dell'altro. Il risultato che si ottiene è un legame triplo.
- &n 515j99f bsp; LEGAME COVALENTE POLARE
Atomi di elementi differenti possono legarsi con legami covalenti. In questo caso però gli elettroni condivisi non si troveranno più simmetricamente distribuiti all'interno dell'orbitale molecolare, ma addensati maggiormente verso l'atomo più elettronegativo.
L'orbitale molecolare che si verrà a formare in seguito al legame quindi non sarà più perfettamente simmetrico, ma si presenterà con un maggior addensamento elettronico nella regione dello spazio intorno all'elemento più elettronegativo. Questo tipo di legame covalente si chiama legame covalente polare.
Quando sono presenti legami covalenti polari è possibile che la molecola che si forma abbia essa stessa una struttura polare. Questo è il caso, ad esempio, del cloruro di idrogeno, una molecola biatomica formata da un atomo di idrogeno legato ad uno di cloro in cui la coppia elettronica di legame non è perfettamente condivisa fra i due atomi. Il cloro, avendo elettronegatività pari a 3,0, superiore quindi a quella dell'idrogeno (2,1) attira su di sé, con maggior forza, la nuvola elettronica e pertanto la molecola HCl assume l'aspetto di un dipolo elettrico. Si indica con (+) l'atomo che presenta una parziale carica positiva e con (-)quello che presenta una parziale carica negativa.
Per l'acqua si verifica una situazione analoga. L'idrogeno ha valore di elettronegatività 2,1 e l'ossigeno 3,5. I legami idrogeno-ossigeno che si formano sono disposti in modo da formare un angolo di 105° circa. Le cariche negative portate dagli elettroni si addensano quindi preferibilmente dalla parte dell'ossigeno, mentre dalla parte degli atomi di idrogeno prevalgono le cariche positive dei protoni. Anche la molecola dell'acqua è quindi un dipolo. &n 515j99f bsp;
Determinati solidi (chiamati solidi atomici) sono costituiti di atomi tenuti insieme da legami covalenti. Le loro proprietà macroscopiche si interpretano proprio alla luce delle caratteristiche del legame covalente. La durezza e l'altissima temperatura di fusione che caratterizza questi solidi, di cui un tipico esponente è il diamante, sono dovute al fatto che il legame covalente, già di per sé molto forte, diventa ancora più intenso quando si estende lungo tutto il solido. Il diamante può essere infatti immaginato come una molecola gigantesca formata esclusivamente di atomi di carbonio legati da coppie di elettroni localizzate in precise direzioni. La fragilità del diamante e la facilità con cui può essere tagliato lungo piani prestabiliti è conseguenza proprio della direzionalità dei legami covalenti che, impedendo ai singoli atomi ogni possibilità di movimento, ne rendono la struttura particolarmente rigida. Così, se il cristallo viene sottoposto a forze molto intense, non essendo in grado di deformarsi, si spezza.
Rappresentazione degli elettroni di valenza nei composti covalenti
Per evidenziare gli elettroni coinvolti nei legami covalenti, si usa spesso il cosiddetto simbolismo di Lewis in cui gli elettroni dell'ultimo livello energetico vengono rappresentati per mezzo di puntini e crocette (Gli elettroni sono tutti uguali: i puntini e le crocette servono solo per distinguere gli elettroni di un atomo da quelli dell'altro).
![]()
Molto usata è anche la rappresentazione orbitalica in cui gli orbitali sono indicati con quadratini e gli elettroni con freccette.
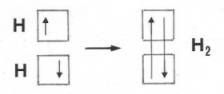
I legami chimici si possono anche rappresentare con trattini, nel modo seguente:
&n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; &n 515j99f bsp; HH ClCl NN OO
In questo caso ogni trattino rappresenta una coppia elettronica di legame, e la raffigurazione prende il nome di formula di struttura. La formula di struttura serve per visualizzare il modo in cui sono legati gli atomi che costituiscono il composto. È in effetti il miglior modo di rappresentare, su una superficie piana, la struttura atomica di una molecola. La strutture di una molecola o di uno ione poliatomico si possono ottenere abbastanza facilmente nota la configurazione elettronica esterna degli elementi costituenti il composto ed alcune semplici regole che verranno qui di seguito elencate:
- &n 515j99f bsp; Decidere qual è l'atomo centrale
- &n 515j99f bsp; Contare gli elettroni di valenza dell'intera molecola
- &n 515j99f bsp; Collegare gli elementi all'atomo centrale con un legame semplice (due elettroni)
- &n 515j99f bsp; Completare gli ottetti degli atomi legati all'atomo centrale
- &n 515j99f bsp; Porre gli elettroni rimasti PER COPPIE sull'atomo centrale
- &n 515j99f bsp; Verificare la regola dell'ottetto
- &n 515j99f bsp; Distribuendo opportunamente gli elettroni, fare in modo che la carica formale su ogni elemento sia il più possibile vicina allo zero
La costruzione della formula di struttura non è, in genere, un'operazione banale deducibile direttamente dalla formula bruta del composto, ma necessita invece di conoscenze riguardanti i tipi di legami presenti, il loro numero e la posizione che gli atomi possono assumere all'interno della molecola.
LEGAME DATIVO
Nei legami di tipo covalente il doppietto elettronico condiviso dai due atomi, è costituito da elettroni provenienti l'uno da un atomo e l'altro dall'altro. I due atomi coinvolti nel legame covalente devono avere pertanto ciascuno almeno un elettrone spaiato sull'ultimo livello quantico.
Nel caso del legame dativo, invece, la coppia di elettroni comuni è data per intero da uno solo degli atomi partecipanti al legame, mentre l'altro mette a disposizione un orbitale vuoto. Questo tipo di legame si chiama covalente dativo, o semplicemente legame dativo.
Esempi di legame dativo si trovano nella formazione degli ioni ammonio. Lo ione H+ è l'atomo di idrogeno privo dell'elettrone e presenta pertanto l'unico orbitale di cui dispone vuoto. D'altra parte, l'atomo di azoto della molecola dell'ammoniaca, NH3, presenta nell'ultimo livello quantico un doppietto elettronico che può essere utilizzato per formare un legame dativo.
Una volta formatosi il legame, la carica elettrica si distribuisce sulla struttura complessiva che quindi si comporta come si trattasse di uno ione formato da un singolo atomo.
LEGAME METALLICO
Il legame metallico è tipico dei metalli, elementi che tendono a cedere elettroni con estrema facilità tendono a trasformarsi in ioni positivi. Tali ioni poi si dispongono in modo ordinato all'interno di una struttura tridimensionale nella quale uno sciame di elettroni, liberi di circolare al suo interno, contribuisce a tenere insieme. Anche nei solidi metallici si possono immaginare, come nei casi analizzati in precedenza, delle coppie elettroniche di legame, solo che in questo caso, invece che essere localizzate in un punto preciso del complesso molecolare, sono delocalizzate su tutta la struttura.
Questo modello spiega in modo coerente tutte le proprietà dei metalli, come per esempio la malleabilità, la duttilità e in genere la facile lavorabilità di queste sostanze. Inoltre, l'elevata conducibilità elettrica e termica si giustifica immediatamente con la notevole mobilità di cui sono dotati gli elettroni: l'azione di un campo elettrico provoca infatti l'immediato trasferimento degli stessi lungo il metallo e analogamente l'aumento di temperatura in una zona del metallo determina l'aumento della loro energia cinetica e la conseguente trasmissione del movimento a quelli presenti nella parte più fredda.
Infine la tipica lucentezza metallica si spiega immaginando che la luce costringa gli elettroni a saltare sui numerosi livelli energetici vuoti e molto vicini gli uni agli altri degli ioni che costituiscono il metallo per poi ricadere ai livelli inferiori restituendo l'energia sotto forma di fotoni di vario tipo, cioè di luce di tutti i colori.
Le caratteristiche metalliche degli elementi si vanno attenuando procedendo lungo il Sistema Periodico, da sinistra a destra. Ciò si giustifica considerando che gli elettroni di valenza aumentano progressivamente in quella direzione riempiendo gli orbitali più esterni. Gli orbitali vuoti, indispensabili per consentire la formazione di legami delocalizzati tipici dei metalli, si fanno sempre più rari.
Legami intermolecolari
Oltre ai legami diretti fra atomi e ioni, illustrati in precedenza, esistono anche altri tipi di legami che si instaurano tra le molecole stesse. Si hanno:
INTERAZIONI DI VAN DER WAALS
Sono legami molto deboli di natura elettrostatica tra molecole polari e non polari indicate genericamente come interazioni di Van der Waals. Si tratta di forze molto deboli e a corto raggio, cioè di forze che fanno sentire i loro effetti solo se le particelle sono molto vicine fra loro.
Le forze di Van der Waals sono sempre presenti nella materia. Se non vi fossero queste forze, in alcuni casi non vi sarebbe alcun legame tra le molecole, e la materia non "starebbe insieme".
Le forze di Van der Waals si chiamano interazioni dipolo-dipolo quando riguardano l'unione di due molecole polari, come potrebbe essere il caso di due molecole di acqua che vengono a contatto.
Si chiamano interazioni dipolo-dipolo indotto quando una molecola polare induce, in una molecola apolare con la quale viene a contatto, una momentanea separazione delle cariche. Fra le due strutture elettriche si instaura a quel punto un legame di tipo elettrostatico.
Esiste anche il caso di due molecole apolari che, per un breve istante possono presentare gli elettroni addensati maggiormente da una parte piuttosto che dall'altra creando un dipolo istantaneo. Ciascun dipolo istantaneo genera intorno a sé un campo elettrico che polarizza a sua volta altre particelle circostanti inducendovi a sua volta un dipolo elettrico istantaneo. I dipoli istantanei possono quindi interagire fra loro con una forza che si chiama interazione dipolo indotto-dipolo indotto.
Le interazioni di Van der Waals possono quindi essere considerate delle specie di legami chimici debolissimi che si formano solo quando le molecole sono a stretto contatto.
LEGAME A IDROGENO
Vi sono molecole fortemente polari, contenenti l'atomo di idrogeno unito con legame covalente ad atomi molto elettronegativi (in pratica solo con fluoro, ossigeno e azoto), in cui esso, polarizzato positivamente, è in grado di stabilire un legame di tipo elettrostatico con atomi elettronegativi presenti nella stessa molecola o in altre molecole vicine. A questo tipo di legame che può essere considerato un caso particolare di legame dipolo-dipolo si dà il nome di legame a idrogeno ed essendo abbastanza forte, presenta le caratteristiche del legame chimico vero e proprio.
In realtà il legame a idrogeno, se preso singolarmente, è piuttosto debole, ma, poiché se ne formano in gran numero contemporaneamente, presi tutti insieme, influiscono in modo determinante sulle proprietà chimiche e fisiche di un composto. Facciamo alcuni esempi per chiarire le caratteristiche del tipo di legame di cui stiamo parlando.
Le proprietà molto
particolari dell'acqua si giustificano con la presenza di legami a idrogeno.
L'acqua è l'unica sostanza naturale che si dilata sia quando viene riscaldata,
sia quando viene raffreddata: la massima densità dell'acqua si raggiunge
infatti a
A causa della leggerezza delle sue molecole (PM=18), l'acqua dovrebbe essere gassosa alla temperatura ambiente, e non liquida come in effetti è. Per confronto si consideri che l'ossigeno, la cui molecola pesa quasi il doppio di quella dell'acqua, a temperatura ambiente si presenta in forma gassosa.
Fra molecole di acqua si instaurano legami a idrogeno. Più precisamente, un atomo di idrogeno di una molecola d'acqua si lega con l'atomo di ossigeno dell'altra facendo da ponte fra due atomi di ossigeno: l'uno, quello interno alla molecola, legato con legame covalente, l'altro, quello della molecola che le sta a fianco, legato con legame a idrogeno. Il legame a idrogeno è detto anche "ponte idrogeno".
Il numero dei legami a idrogeno presenti nell'acqua dipende dalla temperatura: più questa è bassa maggiore è il numero dei legami; quando l'acqua diventa ghiaccio questi legami sono molto numerosi e praticamente coinvolgono tutta la struttura. In conseguenza di questa ragnatela di legami, le molecole sono tenute a distanza le une dalle altre e ordinatamente bloccate in una disposizione rigida con più spazi vuoti di quanti non ve ne siano quando la sostanza è allo stato liquido. Questo è il motivo per il quale il ghiaccio è meno denso dell'acqua.
Quando il ghiaccio fonde, le molecole acquistano energia, i ponti idrogeno si rompono e le stesse molecole vengono a trovarsi a più stretto contatto le une con le altre. Tuttavia, nell'acqua allo stato liquido, esiste ancora una struttura pseudo-ordinata per la presenza di molti legami a idrogeno che impediscono alle molecole stesse di liberarsi facilmente per passare allo stato aeriforme.
Prima di concludere questo argomento è necessario riesaminare le proprietà dei solidi molecolari per giustificarle alla luce del legame a idrogeno. Le forze che tengono unite le molecole all'interno della struttura cristallina ordinata dei solidi molecolari (si pensi ad una zolletta di zucchero), sono prodotte da legami del tipo delle interazioni di Van der Waals o del tipo del legame a idrogeno. Essendo queste forze attrattive piuttosto deboli, i solidi molecolari risultano fragili e quindi facilmente sfaldabili. Essi inoltre non conducono la corrente elettrica né allo stato solido né a quello liquido per l'assenza di ioni e di elettroni liberi.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025