|
|
| |
Relazione di chimica n°1 del 2-11-06
LA MOLE
Obiettivo: determinare il numero di moli di CO2 che si sviluppa dalla reazione che vede come reagenti HCl al 37% e 5g di CaCO3.
Materiali:
5g di CaCO3 (carbonato di calcio);
20ml di HCl al 37%.
Strumenti:
Cilindro graduato con portata pari a 50ml e con sensibilità ed errore assoluto pari a 1ml;
Bilancia digitale, con portata di 1010g e sensibilità ed errore assoluto pari a 0,01g;
Cucchiaio spatola;
2 vetrini d'orologio;
Guanti protettivi;
Imbuto.
Procedura:
Prendere un vetrino d'orologio contenente una quantità a caso di CoCO3;
Posizionare un altro vetrino d'orologio sulla bilancia e tarare a 0;
Utilizzando un cucchiaio spatola, spostare il CaCO3 sul vetrino posizionato sopra la bilancia, fino a quando non si ottiene una quantità pari a 5g;
Determinare la massa di un cilindro graduato con portata %0ml ed errore assoluto e sensibilità pari a 1ml;
Prendere il cilindro graduato da 50ml in cui erano stati precedentemente versati 20ml di HCl al 37%, e determinarne il peso;
Utilizzando un imbuto e aiutandosi con un cucchiaio spatola, versare i 5g di CaCO3 all'interno del cilindro contenente i 20ml di HCl al 37% e osservare la reazione;
Una volta finita la reazione ripesare il cilindro graduato e annotare il risultato;
Per la pericolosità dell'HCl, per quanto riguarda gli ultimi 3 passaggi è necessario lavorare sotto cappa;
Determinare infine sapendo la reazione, le moli di CaCO3 e HCl di partenza, della CO2 che si è generata e del CaCl2 che si è prodotto.
Accorgimenti:
Per la pericolosità dell'HCl è necessario lavorare sotto cappa durante i passaggi che ne richiedono l'utilizzo;
Quando si opera con l'HCl, sempre per la stessa ragione riportata nel punto precedente, è necessario lavorare utilizzando appositi guanti protettivi.
Rappresentazione iconica dell'esperienza:
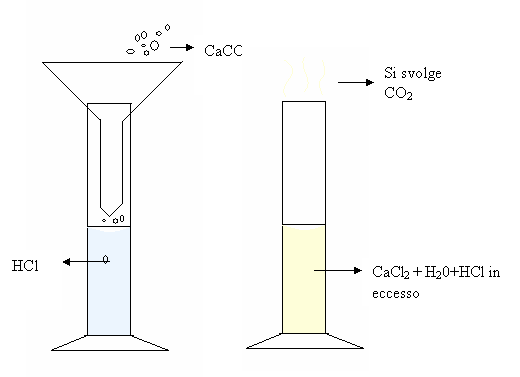
Rielaborazione e raccolta dati:
|
Massa cilindro graduato |
HCl+cilindro graduato |
HCl al 37% |
Cilindro graduato dopo la reazione |
|
73,20g +/- 0,01g |
97,00g +/- 0,01g |
23,80g +/- 0,02g |
99,75g+/- 0,01g |
Grammi effettivi di HCl:
v HCl al 37% : (cilindro graduato + HCl) - cilindro graduato
(97g +/- 0,01g ) - (73,2g +/- 0,01g)= 23,8g +/- 0,02g
v HCl effettivo:
23,8g:X=100%:37%
X= (23,8g ∙ 37%)/100% = 8,8g
Calcolo quante Moli in 8,8g di HCl:
v 1Mole di HCl = 1g(H)+35,5g(Cl)= 36,5g
36g:1Mole=8,8g:X
X= (1Mole ∙ 8,8g)/36g= 0,24moli
Calcolo quante Moli in 5g di CaCO3:
v 1Mole di CaCO3: 40g(Ca)+12g(C)+16g(O) ∙ 3 = 100g
100g:1Mole=5g:X
X= (1Mole ∙ 5g)/100g= 0,05moli
Evidentemente l'acido è in eccesso: infatti in base alla stechiometria della reazione 1 mole di CaCO3 richiede 2 moli di HCl, quindi 0,05 moli richiederebbero 0,1 (= 0,05 ∙ 2) moli di acido mentre ne sono presenti 0,24: quindi tutto il carbonato reagirà, mentre resterà una parte di HCl non reagito. Il numero delle moli di CO2 deve quindi essere calcolato in base a quelle di CaCO3 cioè del reagente in difetto.
Calcolo quante Moli di CO2 si formano:
v sapendo che 1 mole di CaCO3 produce 1 mole di CO2, allora 0,05 moli di carbonato producono 0,05 moli di CO2 , nonché 0,05 moli di H2O e 0,05 moli di CaCl2. a questo punto è possibile calcolare le masse dei composti corrispondenti:
1 mole di CO2 : 12g(C)+16g(O) ∙ 2 = 44g
v massa di CO2 all'interno della reazione: 0,05 ∙ 44g= 2,20g
1 mole di H2O : 1g(H) ∙ 2+ 16g(O)= 18g
v massa di H2O all'interno della reazione: 0,05 ∙ 18g= 0,90g
1 mole di CaCl2: 40g(Ca) + 35,5g(Cl) ∙ 2= 111g
v massa di CaCl2 all'interno della reazione: 0,05 ∙ 111g= 5,55g
1Mole di HCl = 1g(H)+35,5g(Cl)= 36,5g
v massa di HCl all'interno della reazione: 0,10 ∙ 36,5g= 3,65g
v massa di HCl in eccesso : 8,8g-3,6g= 5,2g
Prima della reazione
|
Reagenti |
Quantità di reagente iniziale |
Quantità di composto in eccesso |
Massa dei reagenti durante la reazione |
1 mole del reagente |
Numero di moli in riferimento ai grammi |
|
HCl |
8,8g |
5,2g |
3,65g |
36,5g |
0,10g |
|
CaCO3 |
5g |
|
5g |
100g |
0,05g |
Dopo la reazione
|
Prodotti di reazione |
Massa dei prodotti dopo la reazione |
1 mole del prodotto |
Numero di moli in riferimento ai grammi |
|
CaCl2 |
5,55g |
111g |
0,05 moli |
|
H2O |
0,90g |
18g |
0,05 moli |
|
CO 2 |
0,20g |
44g |
0,05 moli |
Osservazioni e conclusioni:
La mole è una quantità di sostanza che contiene un numero fisso di molecole , ovvero l numero di Avogadro che è pari a 6,02 ∙ 1023, ed ha un peso pari alla massa molecolare relativa espressa in grammi. Con questa esperienza si è voluto dimostrare che quando si ha un reagente in eccesso (nel nostro caso l'HCl) questo reagisce solo in parte con l'altro reagente (che viene invece utilizzato tutto) e la parte restante rimane inutilizzata e miscelata al prodotto di reazione. Facendo reagire HCl e CaCO3 secondo la seguente reazione:
![]() CaCO3 +
2HCl CaCl2 + H2O + CO 2
CaCO3 +
2HCl CaCl2 + H2O + CO 2
Si può notare una chiara effervescenza, segno di fuoriuscita di gas, che nel nostro è CO 2 (e si dice quindi che si svolge anidride carbonica) la soluzione per il resto rimane incolore e senza precipitato, in quanto il CaCl2 è un sale molto solubile.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025