|
|
| |
ACIDI : hanno sapore aspro, sono in grado di sciogliere alcuni metalli, cambiano il colore del
858j93i 858j93i 858j93i tornasole dal blu al rosso, reagiscono con le basi.
BASI : hanno sapore amaro, sono viscide al tatto, cambiano il colore del tornasole dal rosso al
858j93i 858j93i 858j93i blu, reagiscono con gli acidi.
ACIDO : sostanza che libera ioni H+ in soluzione acquosa.
BASE : sostanza che libera ioni OH- in soluzione acquosa.
ACIDO : sostanza in grado di cedere nelle reazioni chimiche ioni idrogeno (protoni). Cioè si rompe un legame covalente tra idrogeno e un altro atomo liberando H+.
BASE : sostanza in grado di acquistare nelle reazioni chimiche ioni idrogeno (protoni). Cioè le basi hanno un doppietto elettronico non condiviso disponibile per formare un legame covalente con un protone .
In questo tipo di reazione lfacido cede un protone e la base acquista un protone.
![]()
![]()
![]()
![]()
![]() H – A + :B 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i
H – B + :A
H – A + :B 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i
H – B + :A
Analizzando questa reazione nel senso della freccia:
· 858j93i Lfacido cede un protone ad una specie che è capace di legarsi al protone più stabilmente dellfacido originario. Quindi il nuovo acido che si è formato H–B è più stabile e quindi più debole di H-A; cioè avendo formato un legame più forte con il protone H+, ha meno tendenza a cederlo rispetto allfacido originario H-A.
Analogamente anche la base B originaria è più forte della base finale A; cioè B ha più tendenza ad acquistare protoni rispetto ad A
Ogni acido, come conseguenza della teoria di BRONSTED – LOWRY, avrà una base corrispondente ed ogni base avrà un acido corrispondente.
Questa coppia acido - base si chiama coppia coniugata.
Cioè lfacido che perde il protone si trasforma nella sua base coniugata e la base che acquista il protone si trasforma nel suo acido coniugato.
858j93i 858j93i 858j93i 858j93i 858j93i - 1 protone
![]() H-A 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i
:A
H-A 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i
:A
acido 1 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i base coniugata 1
858j93i 858j93i 858j93i 858j93i 858j93i + 1 protone
![]() B 858j93i 858j93i 858j93i 858j93i 858j93i
858j93i 858j93i 858j93i 858j93i 858j93i 858j93i H-B
B 858j93i 858j93i 858j93i 858j93i 858j93i
858j93i 858j93i 858j93i 858j93i 858j93i 858j93i H-B
base 2 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i acido coniugato 2
Lfacqua è pochissimo dissociata in ioni. La sua conducibilità, allo stato puro è perciò straordinariamente bassa. l'acqua si deve perciò considerare come un elettrolita molto debole.
Lfequilibrio di dissociazione dellfacqua è il seguente:
![]()
![]() H2O 858j93i 858j93i 858j93i 858j93i
H+ + OH-
H2O 858j93i 858j93i 858j93i 858j93i
H+ + OH-
La costante di dissociazione sarà: ![]()
Il valore [H2O] espresso in moli/litro è di 55,34 (ottenuto dividendo i grammi di acqua non dissociata 997g presenti in un litro di acqua, per la mole dellfacqua 18,05 : grammi /mole = numero di moli ; numero di moli in un litro = molarità.
Lfequilibrio risulta quindi spostato decisamente verso sinistra; dato che la dissociazione è bassissima, il valore [H2O] si può considerare una costante e può essere inglobato nel valore di K.
1,8x10-16 x [H2O] = 1,8x10-16 x 55,34 = 10-14
Si ottiene così una nuova costante indicata dal simbolo Kw che prende il nome di prodotto ionico dellfacqua.
Kw = [H+] x [OH-] = 10-14 858j93i 858j93i 858j93i da cui:
[H+] = [OH-] = 10-7
Per evitare lfuso di esponenti negativi e di numeri molto piccoli la concentrazione degli ioni H+ e OH si esprime mediante i logaritmi. Si chiama pH il cologaritmo della concentrazione degli ioni H+
pH = - log [H+]
per lfacqua avremo: pH = - log [H+] =- - log 10-7 = 7
Le soluzioni che presentano [H+] = 10-7 ossia pH 7 sono neutre
Con pH < 7 sono acide
Con pH > 7 sono basiche
|
Concentrazione H+ |
Concentrazione OH- |
pH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nelle soluzioni acquose diluite il prodotto della concentrazione degli ioni H3O+ e OH- risulta costante. Se introduco un acido o una base o un sale non neutro, la concentrazione singola degli ioni H3O+ e OH- cambia, ma non cambia il prodotto delle loro concentrazioni (= 10-14).
kW = H3O+ OH- = = 10-14 prodotto ionico dellfacqua
Logaritmo di un prodotto è uguale alla somma dei logaritmi dei
singoli fattori.
log. Kw = log. H3O+ OH-
log. Kw = log. H3O+ + log OH-
colog Kw = colog H3O+ + colog OH-
pKw = pH + pOH- .
Il cologaritmo = è il logaritmo cambiato di segno = = - logaritmo
Dato che Kw = 10-14 allora log Kw = -14, pKw = 14
Allfequilibrio il pkW è sempre uguale a 14, infatti il kW è sempre 10-14.
Quindi il pH e il pOH possono variare da 0 a 14 (vedi tabella):
se pH = 13 858j93i pOH = 1
se pH = 7 858j93i 858j93i pOH = 7
pH = 1 858j93i 858j93i pOH = 13
pH = 0 858j93i 858j93i pOH = 14
![]() HCl 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i
H+ + Cl-
HCl 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i 858j93i
H+ + Cl-
Ka 858j93i = ![]()
Log Ka = log ![]()
Log Ka = log H+ + log Cl- - log HCl
log Ka = - log H+ - log Cl- + log HCl
pK = pH - log Cl- + log HCl
Il pK sarà uguale al pH quando Cl- è uguale a HCl
Per cui - log Cl- + log HCl risulta uguale a 0.
Cioè il pH è uguale al pK quando lfacido è dissociato per metà.
Quanto più alta è la Ka tanto più piccolo è il pK e tanto più dissociato è lfacido.
Si determina tenendo presente che per gli acidi forti (completamente dissociati) la [H+] è uguale alla normalità dellfacido
Es.: una soluzione 1 N di H2SO4 (cioè 49 grammi per litro) contiene 1 grammoione /litro di H+ cioè : [H+] = 1
una soluzione 0,1 N di H2SO4 (cioè 4,9 grammi per litro) contiene 0,1 grammoioni/litro di H+ cioè [H+] = 0,1
Es: HCl N/100 (o 1/100N o 0,01N o 10-2N): [H+] = normalità = 10-2
pH = - log 10-2 = 2
Per gli acidi e basi deboli il calcolo del pH è dato dalla seguente espressione:
![]()
dove KA è la costante di dissociazione dellfacido o base debole e CA è la concentrazione dellfacido.
Quindi per il calcolo del pH di acidi e basi deboli bisogna conoscere la costante di dissociazione e la concentrazione. Infatti:
![]()
![]() HA 858j93i 858j93i
H+ + A-
HA 858j93i 858j93i
H+ + A-
da cui:
) ![]()
Dal momento che [H+] = [A-], come risulta dalla reazione di equilibrio allora [H+]x [A-] = [H+]2 .Sostituendo nella
) ![]()
Ma dellfacido non dissociato [HA] ,essendo lfacido debole, si può considerare con buona approssimazione uguale alla concentrazione dellfacido di partenza CA
[HA] CA
Quindi sostituendo nella
) 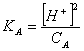 da
cui
da
cui
![]()
Es.
Calcolare il pH di una soluzione di CH3COOH 0,1 N sapendo che la sua KA = 10-5
![]() = 10-3 858j93i pH
= - log 10-3 = 3
= 10-3 858j93i pH
= - log 10-3 = 3
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025