|
|
| |
Verifica della legge di proust
Obiettivo
Verificare la validità della legge di Proust secondo cui in un composto, il rapporto tra le masse degli elementi che compaiono nella formula chimica è definito e costante.
Principio
Si prendono in considerazione due Sali di Rame e cloro in cui i rapporti tra i due elementi siano diversi:
Cloruro rameico CuCl2 , Cloruro rameoso CuCl
Determiniamo il peso di ciascun elemento tramite la misura del peso del rame grazie alla reazione con alluminio che lo porta allo stato metallico insolubile e quindi facilmente separabile dalla soluzione.
Il peso del cloro lo determiniamo per differenza dalla quantità di sale iniziale.
Da notare che il cloruro rameico si presenta con due molecole di acqua di cristallizzazione, pertanto occorre tenerne conto nei calcoli.
Le reazioni prese in considerazione sono:
esperimento
1. 3 CuCl2 + 2Al ![]() 2Al Cl3
+ 3Cu↓
2Al Cl3
+ 3Cu↓
esperimento
2. 3 CuCl + Al ![]() Al Cl3
+ 3Cu↓
Al Cl3
+ 3Cu↓
Pianificazione dell'esperimento:
I gruppi 2, 4, 6, 8, 10 eseguiranno l'esperimento 1. Partendo da pesate di 323g64d cloruro rameico differenti.
I gruppi 1, 3, 7, 9, 11 eseguiranno l'esperimento 2. Partendo da pesate di 323g64d cloruro rameoso differenti.
Il nostro gruppo ( gruppo 4 ) si occuperà dell'esperimento 1.
Materiale
Becker da 150ml e 250ml
Bacchetta di vetro
Vetrino da orologio
Pinza di ferro
Pinza di legno
Spruzzetta con acqua distillata
Bunsen con treppiede e reticella
Termostato
Essiccatore
Bilancia tecnica ( sensibilità ± 0,01g )
Reagenti:
Acqua distillata
CuCl2 * 2H2O cloruro rameico bi idrato tossico simbolo: T
CuCl cloruro rameoso nocivo simbolo: Xn
Al lamina di Alluminio
NH4Cl cloruro d'ammonio
Indicazioni di sicurezza:
visto l'utilizzo di sostanze tossiche e nocive per ingestione o contatto con la pelle si consiglia l'utilizzo di camice e guanti durante la manipolazione
durante l'esperimento si portano ad ebollizione soluzioni in becker, si consiglia l'utilizzo di camice e occhiali protettivi per prevenire eventuali schizzi
dovendo scaldare i becker su bunsen e in stufa è opportuno l'utilizzo delle apposite pinze per spostare gli oggetti caldi. Inoltre per fermare l'ebollizione, non è necessario spostare il becco bunsen acceso da sotto il trepiede, ma è sufficiente spegnere il gas.
Schema



Becco bunsen con treppiede Essiccatore Bilancia tecnica
e reticella
Procedimento
A ciascun gruppo viene assegnato un vetrino da orologio contenente uno dei due Sali in diverse quantità.
Al nostro gruppo è assegnato il vetrino n°4 contenente 1,50 g di CuCl2 * 2H2O sale colore blu ??
Il cloruro rameico viene versato in un becker da 250ml, precedentemente tarato, si aggiungono circa 100ml di acqua distillata e con una bacchetta di vetro si agita la soluzione che assume un colore azzurro.
Agitando di tanto in tanto con la bacchetta si porta ad ebollizione la soluzione, quindi, dopo aver spento il bunsen e lasciato raffreddare il becker vi si immerge una sottile lamina di alluminio che presenta una superficie grigia e lucida.
Lo sviluppo di numerose bollicine attorno all' alluminio non è dovuto alla reazione tra CuCl2 e Al, in quanto la reazione non produce gas, ma al fatto che la laminetta metallica favorisce l'evaporazione dell'acqua anche perché la reazione è esotermica e quindi sviluppa calore che favorisce ulteriormente l'ebollizione dell'acqua.
Dopo circa 20 minuti, avendo cura di muovere l' alluminio con la bacchetta di vetro, la soluzione diventa incolore e si forma un precipitato rossiccio dovuto al rame metallico che precipita, mentre l'alluminio cloruro resta in soluzione.
Il rame viene poi separato per decantazione:
si estrae la laminetta dal becker con una pinza metallica lavandola con acqua e facendo attenzione che tutto il precipitato resti nel becker; la lamina di alluminio si presenta ora imbrunita e opaca in quanto la superficie della lamina viene attaccata in modo disomogeneo.
Si lascia che tutto il rame si depositi sul fondo e quindi si versa il liquido molto dolcemente per evitare che il precipitato si muova e venga versato via.
Lavare il precipitato con poca acqua distillata e decantare nuovamente.
Ripetere il lavaggio con acqua quindi lavare con etanolo per favorire l'essicazione.
Mettere il becker in stufa per un po' di tempo quindi estrarlo con la pinza di legno e metterlo in essiccatore finché non è raffreddato.
Pesare il becker sulla bilancia e annotare il peso.
Per i gruppi cui è stato assegnato CuCl il procedimento presenta una sola variazione:
per solubilizzare il sale non si aggiunge acqua, ma una soluzione di NH4Cl per favorire la solubilizzazione del cloruro rameoso, in quanto l'NH3 forma un complesso con lo ione Cu+ molto solubile.
Da notare che questa variante non influenza l'andamento dell'esperimento.
Dati
I dati relativi ai gruppi, la loro elaborazione e gli errori associati alle misure e ai valori derivati, sono riportati nelle tabelle allegate.
Calcoli
Per i gruppi che avevano cloruro rameico bi idrato è necessario calcolare il corrispondente peso di cloruro rameico anidro:
PM CuCl2 * 2H2O = 170.45
PM CuCl2 = 134.45
Equivalenza g (CuCl2 * 2H2O) : 170.45 = g (CuCl2anidro) : 134.45
Quindi g (CuCl2 * 2H2O) x 134.45/170.45 = g (CuCl2anidro) colonna "B"
Per calcolare la quantità di rame presente nel sale: peso finale becker con rame precipitato - tara becker colonna "E"
Per calcolare la quantità di cloro presente nel sale: la quantità di cloro si ottiene per differenza tra il peso iniziale del sale ( per il CuCl2 quello anidro ) e il peso del rame colonna "F"
Per calcolare l'errore associato alle misure ricordiamo che
per la bilancia in assenza di ulteriori informazioni l'errore associato alla misura corrisponde alla sensibilità della bilancia stessa
quando si sommano o sottraggono grandezze, l'errore assoluto complessivo è uguale alla somma dei singoli errori assoluti
quando si moltiplicano o dividono grandezze, l'errore relativo (errore assoluto/misura) complessivo è uguale alla somma dei singoli errori relativi e per calcolare l'errore complessivo assoluto, basta moltiplicare l'errore relativo per il valore a cui è associato. colonna "H"
Il rapporto Cl/Cu, colonna "G" per ogni tipo di sale dovrebbe restare costante cambiando la quantità di partenza a meno degli errori sperimentali.
Se questa condizione viene rispettata possiamo affermare la validità della legge di Proust
Se questa condizione non viene rispettata possiamo affermare che gli errori casuali incidono in modo sostanziale per cui occorrerà una revisione accurata del procedimento per capire quali possono essere state le fonti di errore che sono sfuggite al nostro controllo. Per verificarlo basta sottrarre al rapporto Cl/Cu calcolato, il rapporto teorico, che, in valore assoluto, colonna "DG" dovrebbe essere inferiore all'errore associato colonna "H" per calcolare il rapporto teorico tra cloro e rame nei due sali basta fare il rapporto tra i pesi atomici dei due elementi moltiplicati per il n° di volte che compaiono nella formula molecolare:
CuCl2 : Cl/Cu = (2 x 35,45) / 63,55 = 1,12
CuCl : Cl/Cu = 35,45 / 63,55 = 0,56
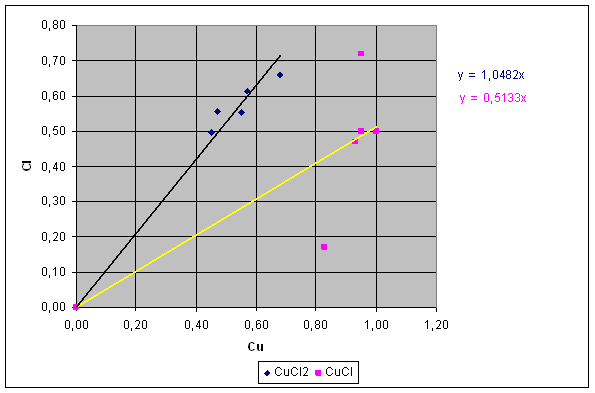
Se per ogni quantità dello stesso tipo di sale si mette in grafico il peso del cloro contro il peso di rame dovrei ottenere una retta passante per l'origine il cui coefficiente angolare corrisponde al rapporto dei singoli elementi nel sale : Y = mX dove Y =Cl ; X = Cu ; m (coefficiente angolare) = Cl/Cu coefficiente angolare CuCl2 : 1,0482
coefficiente angolare CuCl : 0,5133 grafico 1
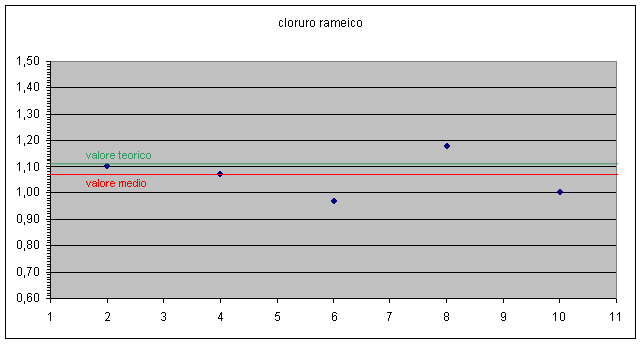
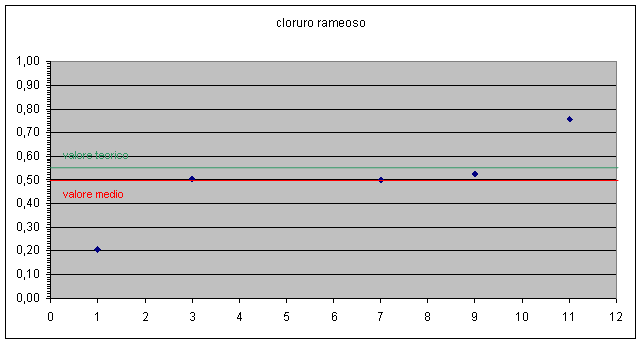
E' possibile evidenziare in grafico anche la dispersione dei dati ottenuti rispetto al valore teorico e anche lo scostamento del valore medio da quello teorico. grafico 2, 3
Conclusioni
Dai dati emersi possiamo concludere che i gruppi 1, 2, 4, 8, 9 sono quelli che hanno ottenuto dei valori in linea, a meno degli errori sperimentali, con i valori attesi.
Gli altri gruppi evidentemente hanno commesso errori accidentali non imputabili strettamente alle misure effettuate.
Per i valori più alti si può ipotizzare una perdita di rame dovuta alla decantazione troppo veloce o al fatto che il rame non ha fatto in tempo a reagire completamente con l'alluminio.
Per i valori più bassi si può ipotizzare che non si sia essiccato completamente il rame in stufa o non si sia lavato sufficientemente il precipitato lasciando cloruro d'alluminio che poi ha incrementato il peso del rame.
I gruppi 1 e 11 si sono discostati notevolmente dal valore atteso.
Possiamo concludere comunque che i valori medi dei rapporti Cl / Cu così come i coefficienti angolari delle rette Cl contro Cu ( due modi differenti di mediare i valori ), sono abbastanza vicini ai valori attesi ( all'interno della finestra di errore i valori relativi a CuCl2 , leggermente fuori quelli relativi a CuCl ).
Detto ciò possiamo considerare vera la legge di Proust secondo cui in un composto, il rapporto tra le masse degli elementi che compaiono nella formula chimica è definito e costante.
In più, visto che abbiamo combinazioni diverse di due elementi in due composti differenti, possiamo anche andare a verificare la validità della legge delle proporzioni multiple ricavata sperimentalmente da John Dalton, secondo la quale quando due elementi si combinano in modi diversi per formare diversi composti, il rapporto delle masse di un elemento con la stessa massa dell'altro elemento stanno tra loro in un rapporto che si può esprimere con frazioni di numeri interi e generalmente piccoli.
I rapporti calcolati da noi indicano quanti grammi di cloro si combinano con 1g di rame nei due sali, perciò per verificare la legge di Dalton è sufficiente dividere fra loro i due rapporti medi da noi ottenuti relativi al cloruro rameico e rameoso:
In questo caso il calcolo relativo ai coefficienti angolari si avvicina molto al valore teorico perciò possiamo tranquillamente affermare che la legge di Dalton è valida!!
Grafici
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025