|
|
| |
La glicolisi e il destino del piruvato
La glicolisi è una via metabolica, presente in tutti gli organismi viventi, che converte il glucosio in due molecole di piruvato generando energia metabolica sottoforma di ATP. Negli organismi aerobi essa prelude al ciclo di Krebs e alla catena di trasporto degli elettroni, con cui si ottiene l'ossidazione completa del glucosio a H2O e CO2.
Negli organismi anaerobi il piruvato viene ridotto in vari composti in assenza di ossigeno. Ad esempio l'etanolo è il prodotto della conversione del
piruvato in alcuni lieviti. Anche negli aerobi però, se la fibrocellula
muscolare è impegnata improvvisamente in uno contrazione intensa e non è
sufficientemente rifornita di ossigeno, il piruvato 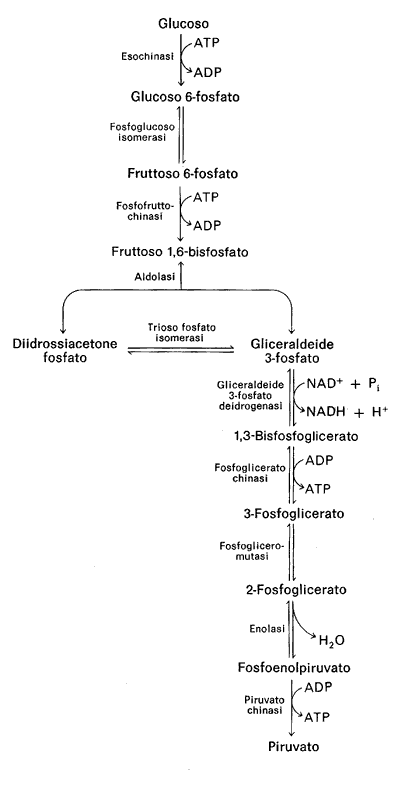 viene ridotto a lattato. Sia l'etanolo che il lattato sono esempi
di fermentazione che è una via strategica, come vedremo, di ricavare energia
immediata riossidando il NADH citoplasmatico formatosi in una tappa della
glicolisi.
viene ridotto a lattato. Sia l'etanolo che il lattato sono esempi
di fermentazione che è una via strategica, come vedremo, di ricavare energia
immediata riossidando il NADH citoplasmatico formatosi in una tappa della
glicolisi.
Le tappe: Il glucosio, entrato nella cellula sotto stimolo ormonale, viene immediatamente fosforilato in posizione '6. Questo passaggio catalizzato dalla glucochinasi nel fegato e dalla esochinasi nel muscolo e nel cervello, attiva il glucosio e lo incanala verso il suo destino metabolico (che non è solo la 727c21h glicolisi). Si ha quindi consumo di una mole di ATP perché le chinasi trasferiscono un gruppo fosfato dall'ATP al substrato (esse necessitano della presenza di ioni Mg+2 necessari all'idrolisi dell'ATP). Se la cellula ha bisogno di ricavare energia il glucosio-6-P subisce una isomerizzazione a fruttosio-6-P. Con ciò l'anello piranosico del glucosio viene convertito in quello furanosico, più instabile. Una nuova chinasi, la fosfofruttochinasi (PFK) trasferisce un secondo gruppo fosfato in posizione '1 formando il fruttosio 1,6 difosfato. Si consuma così un'altra mole di ATP e si crea una molecola particolarmente instabile. Il passaggio della PFK è irreversibile e il suo prodotto, il fru-1,6difosfato, è destinato alla successiva rottura e quindi "obbligato" a continuare nella via glicolitica. Ma questa tappa è cruciale perché la PFK è un enzima allosterico modulato a feedback dall'ATP e dall'acido citrico, primo intermedio del ciclo di Krebs. Osservare che nella glicolisi intervengono tre chinasi e tutte controllano tappe irreversibili. La esochinasi, la fosfofruttochinasi e la piruvatochinasi, sono presidi allosterici per il controllo enzimatico della produzione di energia.
La rottura del fruttosio 1,6 difosfato produce il chetotrioso diidrossiacetone fosfato e l'aldotrioso gliceraldeide 3-fosfato.
Il diidrossiacetone viene convertito in gliceraldeide-3-fosfato che continua la via metabolica.
Fino a questo punto la glicolisi è in rimessa energetica, avendo consumato due moli di ATP (con le fosforilazioni operate dalle chinasi) ed ha trasformato il glucosio in due molecole di gliceraldeide-3-P.
D'ora in poi dovremo moltiplicare per due!
Comincia così una fase di recupero che oltre ad ATP produrrà coenzimi ridotti.
La gli-3-P viene ossidata a difosfoglicerato ad opera di una deidrogenasi NAD+ dipendente. Sommando un fosfato in posizione '1 si ha la rimozione di uno ione idruro che con il suo doppietto elettronico riduce il NAD in NADH trasferendo l'energia di legame dal substrato al coenzima ridotto. Il NADH citoplasmatico così formato dovrà essere riossidato. Potrà entrare nei mitocondri ed inserirsi nella catena di trasporto di elettroni alla fine della quale per ogni NADH riossidato si sintetizzano 3 moli di ATP. Ricordando che i NADH formati in questa tappa sono 2, potenzialmente potrebbero, da soli, produrre 6 moli di ATP!
La tappa successiva mette in pareggio il bilancio di ATP prodotto e consumato. Infatti, una nuova chinasi trasferisce il gruppo fosfato in posizione 1 del difosfoglicerato all'ADP generando una mole di ATP ( moltiplicato x 2 = 2 moli di ATP). Dopo una tappa di riarrangiamento, il 2-fosfoglicerato viene deidratato. La deidratazione provoca la formazione di un doppio legame tra i carboni e si forma il fosfoenolpiruvato (PEP), già visto per il suo alto potenziale di trasferimento di fosfato. Infatti nella ultima tappa la piruvato chinasi trasferisce un fosfato dal PEP all'ADP con formazione di nuovo ATP (2 moli) a livello del substrato. Si forma il piruvato, un importante chetoacido centrale nel metabolismo, non solo energetico.
Termina così la glicolisi che ha prodotto 2 moli nette di ATP e 2 moli di NADH (che, se riossidato nella catena respiratoria, produrrà ulteriori 6 moli di ATP).
Reazione complessiva:
Glucosio + 2Pi + 2ADP + 2NAD+ piruvato + 2ATP +2NADH + 2 H+ + 2 H2O
Osservazioni importanti:
- Da quanto detto si capisce che ci sono due modi per produrre ATP. A livello del substrato quando una chinasi trasferisce un fosfato da una molecola (substrato) ad alto potenziale di trasferimento all'ADP e a livello della catena respiratoria nella riossidazione dei coenzimi ridotti.
- Nella tappa n° 6 si ha una deidrogenazione NAD dipendente. Dal substrato, la gli-3-P, viene rimosso uno ione idruro che si addiziona all'anello nicotinammidico del NAD+ riducendolo a NADH. (Ricordate? SH2 + I IH2 + S: ma perché SH2 possa essere nuovamente ossidato occorre che IH2 venga riossidato in I [in questo caso NADH] in una diversa reazione). Allora questo passaggio può andare avanti solo in presenza, appunto, di NAD ossidato. Nelle restanti tappe della glicolisi, non ce n'è una che "si occupi" di riossidare il NADH! Allora? Quando tutto il NAD+ sarà consumato, la glicolisi non può andare avanti e si blocca! Ma è possibile bloccare la principale via metabolica del catabolismo energetico? No, allora cosa succede?
La glicolisi, come detto, è una via universale, presente cioè in tutti gli organismi viventi e in tutti i tipi di cellule. Questa è un ottima dimostrazione di come, nel corso dell'avventura biologica del pianeta essa abbia "vinto" la pressione selettiva e si sia affermata come la via migliore per estrarre ATP dal glucosio.
Il piruvato invece ha un destino diverso che dipende da tipo di organismo e anche, all'interno del medesimo organismo, dal tipo di cellula (in certe condizioni). Vediamo alcuni esempi:
In alcuni microrganismi e nei lieviti il piruvato viene ridotto ad
etanolo in due passaggi: una 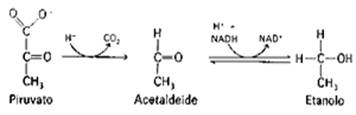 decarbossilazione ed una deidrogenazione.
decarbossilazione ed una deidrogenazione.
La prima tappa, la decarbossilazione, è operata da un enzima contenente, come coenzima, una vitamina idrosolubile, la tiamina pirofosfato un trasportatore di CO2. La seconda tappa è una riduzione operata da una deidrogenasi NAD dipendente. Si ha così, in questi organismi la riossidazione del NADH citoplasmatico! Nel complesso questa via metabolica si chiama fermentazione alcolica.
In moltissimi microrganismi e anche nelle cellule muscolari degli organismi superiori, quando la disponibilità d'ossigeno è insufficiente, il piruvato viene ridotto a lattato (acido lattico). Questa riduzione è il passaggio che permette di riossidare il NADH citoplasmatico.
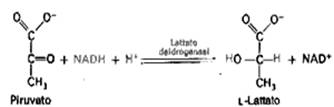
Il piruvato viene ridotto a lattato nelle fibrocellule muscolari quando, per una insufficiente ossigenazione esso non può proseguire nel catabolismo aerobico che, come vedremo, proseguirà nei mitocondri.
Quando la cellula muscolare è chiamata ad uno sforzo molto intenso e/o improvviso, essa ha bisogno di contrarsi indipendentemente dalla ossigenazione. Tale contrazione, in condizioni anaerobiche, non può durare per molto tempo perché l'acido lattico che viene prodotto è tossico e non può essere accumulato, pena il blocco dell'attività muscolare. La conversione del glucosio in lattato si chiama fermentazione lattica. Si ha così la rigenerazione del NAD+ che mantiene costante il flusso della glicolisi in condizioni anaerobiche. Osservare che la riduzione del piruvato e la contemporanea riossidazione del NADH sottrae alla cellula i coenzimi che, in condizione aerobica entreranno nei mitocondri dove la loro riossidazione produrrà 3 moli di ATP per ogni coenzima. Quindi la riduzione a lattato è una reazione "in salita" necessaria però in condizioni anaerobiche permettendo alla glicolisi di continuare a livello della gli-3-P.
La via aerobica del piruvato
In condizioni di sufficiente ossigenazione il piruvato viene decarbossilato, ossidato e addizionato al CoA da un complesso enzimatico mitocondriale chiamato, nel suo insieme, complesso della piruvato deidrogenasi.
I mitocondri
Prima di affrontare lo studio del metabolismo finale è indispensabile conoscere un po' meglio la struttura dei mitocondri.
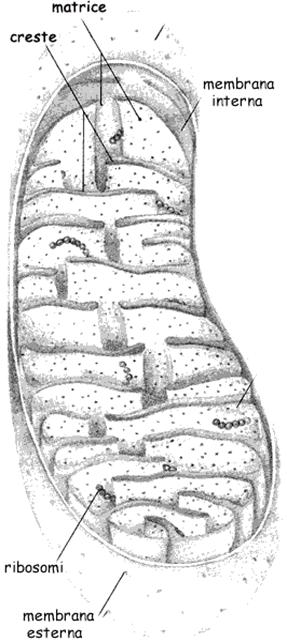
I mitocondri sono le "centrali energetiche della cellula". Sono organuli caratteristici delle cellule eucariotiche e si pensa che derivino dalla simbiosi di archeobatteri Gram negativi che contenevano già i sistemi per operare la fosforilazione ossidativa con cellule eucariotiche anaerobiotiche primitive. Molte sono infatti le analogie della struttura mitocondriale con quella dei batteri Gram negativi. Nella matrice mitocondriale è presente, come nei batteri, DNA circolare. Inoltre nella matrice troviamo ribosomi, segno di possibilità di svolgere sintesi proteica autonoma. La duplicazione dei mitocondri avviene indipendentemente da quella della cellula. Tutto questo conferisce ai mitocondri una parziale autonomia dalla cellula che li ospita. Nei procarioti, batteri in particolare, un corrispettivo mitocondriale è rappresentato dai mesosomi, ripiegamenti della membrana nei quali si trovano gli enzimi del metabolismo energetico.
I mitocondri hanno due membrane: la membrana esterna è permeabile a piccole molecole e a ioni per la presenza di canali proteici costituiti da porina.
La membrana interna invece è praticamente impermeabile e la possibilità di essere attraversata è legata alla presenza di trasportatori specifici per quella determinata molecola. La membrana interna aumenta enormemente la sua superficie con numerose involuzioni e introflessioni chiamate creste mitocondriali. Nella membrana interna sono presenti i complessi enzimatici della catena respiratoria, quelli della sintesi di ATP (ATPsintasi), dell'importazione di ADP e dell'esportazione dell'ATP prodotto.
La matrice contiene il complesso della PDH, gli enzimi del ciclo di Krebs, quelli della ossidazione degli acidi grassi e degli aminoacidi.
E' interessante osservare come le membrane interne dei mitocondri delle cellule cardiache contengono circa 30.000 gruppi di trasporto di elettroni, il triplo rispetto a quelli delle cellule di fegato. Negli spermatozoi i mitocondri sono numerosissimi e consentono il rifornimento di energia a queste cellule per percorrere l'enorme tragitto (rispetto alle loro dimensioni) che dal canale vaginale porta all'ovidotto.
Come abbiamo visto, i processi ossidativi a carico dei nutrienti procedono come catene di smontaggio in cui i substrati subiscono deidrogenazioni operate dai coenzimi delle deidrogenasi che si riducono addizionando elettroni e protoni. Su questi coenzimi, NADH e FADH2 viene così trasferita l'energia potenziale di legame. Essi verranno incanalati, nei mitocondri, nella catena di trasporto di elettroni, la catena respiratoria, fino all'accettore finale, l'ossigeno che si riduce ad acqua e che in un certo senso "attrae" il flusso elettronico grazie al suo elevato potenziale d'ossidazione. La definitiva cessione di elettroni all'ossigeno provoca la liberazione dell'energia necessaria per innescare la fosforilazione ossidativa, reazione endoergonica in cui l'ADP addiziona Pi generando ATP.
Il problema del NADH citosolico formatosi nella glicolisi.
 Se il NADH citoplasmatico prodotto nella glicolisi non venisse
riossidato, questa fondamentale via metabolica si bloccherebbe a livello della
gliceraldeide 3-P. E' necessario quindi che gli elettroni del coenzima ridotto
possano raggiungere i complessi della catena respiratoria e quindi superare
"l'ostacolo" dell'impermeabilità della membrana interna dei
mitocondri. La cellula ha risolto egregiamente il problema con sistemi di
trasporto chiamati shuttle o "sistemi navetta". Nel fegato, nel rene
e nel cuore è attivo il sistema di trasporto chiamato shuttle
dell'aspartato-malato in cui gli elettroni sono trasferiti dal NADH
all'ossalacetato citosolico rigenerando NAD+. L'addizione di H
all'ossalacetato produce malato che può attraversare la membrana interna
essendo questa provvista di un trasportatore proteico specifico per il malato.
All'interno dei mitocondri il malato viene deidrogenato rigenerando NADH che
sarà ossidato nella catena respiratoria.
Se il NADH citoplasmatico prodotto nella glicolisi non venisse
riossidato, questa fondamentale via metabolica si bloccherebbe a livello della
gliceraldeide 3-P. E' necessario quindi che gli elettroni del coenzima ridotto
possano raggiungere i complessi della catena respiratoria e quindi superare
"l'ostacolo" dell'impermeabilità della membrana interna dei
mitocondri. La cellula ha risolto egregiamente il problema con sistemi di
trasporto chiamati shuttle o "sistemi navetta". Nel fegato, nel rene
e nel cuore è attivo il sistema di trasporto chiamato shuttle
dell'aspartato-malato in cui gli elettroni sono trasferiti dal NADH
all'ossalacetato citosolico rigenerando NAD+. L'addizione di H
all'ossalacetato produce malato che può attraversare la membrana interna
essendo questa provvista di un trasportatore proteico specifico per il malato.
All'interno dei mitocondri il malato viene deidrogenato rigenerando NADH che
sarà ossidato nella catena respiratoria.
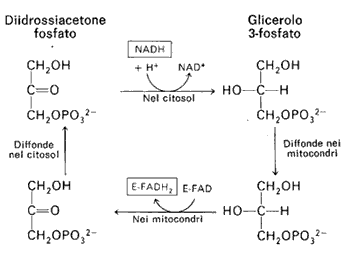
Nel muscolo scheletrico opera un'altro sistema navetta chiamato shuttle del glicerolo 3-P che, come si vede in figura, si forma dalla deidrogenazione del diidrossiacetone fosfato ad opera della glicerolo 3-P deidrogenasi con la conseguente riossidazione citosolica del NADH. Gli equivalenti riducenti (elettroni) vengono trasportati sulla superficie esterna della membrana interna dove una seconda glicerolo 3-P deidrogenasi, FAD dipendente, rigenera la molecola del diidrossiacetone fosfato. Si forma però FADH2 la cui riossidazione nella catena respiratoria, come sappiamo produrrà due sole moli di ATP
Il ciclo di Krebs
(chiamato anche ciclo dell'acido citrico o ciclo degli acidi tricarbossilici)
Quando l'ossigenazione della cellula è sufficiente e il fabbisogno di un surplus di energia immediata non è un emergenza, il piruvato citosolico viene trasportato nei mitocondri e, in quella sede, subisce l'azione della piruvato deidrogenasi (PDH), un complesso enzimatico estremamente raffinato. L'azione della PDH produce acetil-CoA. Vediamo meglio.
In Escherichia Coli la PDH è costituita da numerose copie di tre diversi enzimi (una sessantina di catene polipeptidiche).
Un enzima l'E1, che è l'enzima deidrogenante NAD+ dipendente contiene la tiamina pirofosfato (TPP) che è un trasportatore di unità monocarboniose (CO2) e che quindi opera la decarbossilazione ossidativa del piruvato. Un enzima E2, contiene l'acido lipoico che provvede al trasferimento dell'acile al CoA e l'ultimo enzima E3, che rigenera l'acido lipoico.
Il risultato dell'azione della PDH è quindi:
piruvato + CoA + NAD+ acetil-CoA + Co2 + NADH
In questo passaggio due dei sei atomi di carbonio del glucosio sono stati completamente ossidati a CO2. (entrano due moli di piruvato ed entrambi vengono decarbossilati con produzione di CO2.)
Ricordando la reazione globale dell'ossidazione completa del glucosio...
C6H12O6 + 6O2 6CO2 + 6H20 + ATP (38)
...scopriremo che nel ciclo di Krebs vengono ossidati gli altri quattro atomi di C, producendo le altre quattro molecole di CO2 e dove si formerà l'acqua metabolica.
Negli animali il passaggio da piruvato ad acetil-CoA è un passaggio irreversibile e fondamentale nel metabolismo poiché gli eterotrofi non sono in grado di convertire l'acetil-CoA in glucosio per cui questa conversione dirige gli atomi di C del glucosio o verso il ciclo di Krebs per ricavarne energia oppure nella sintesi di lipidi.
Quando i livelli di ATP nella cellula sono elevati, la conversione del piruvato in acetil-CoA non deve avvenire perché il piruvato viene utilizzato prevalentemente per la gluconeogenesi.
L'attività della PDH, enzima allosterico in un punto d'incrocio fondamentale, è controllata in modo estremamente rigoroso. L'aumento del NADH, dell'acetil-CoA, dell'ATP inattiva il complesso. In sintesi la deidrogenasi viene inibita quando l'ATP o i suoi intermedi biosintetici sono abbondanti.
I due acetati formati dalla conversione del piruvato e addizionati al CoA contengono i restanti 4 atomi di carbonio del glucosio.
Il ciclo dell'acido citrico consiste in una serie di reazioni catalizzate da enzimi localizzati nella matrice mitocondriale, tranne uno, la succinico deidrogenasi che è una proteina della membrana interna del mitocondrio.
In queste reazioni ciascun acetato sarà completamente ossidato a CO2 e si avrà produzione di tre molecole di NADH e una di FADH2.
Su questi coenzimi sarà così trasferita l'energia contenuta nei legami che hanno generato glucosio durante la biosintesi diretta dall'energia elettromagnetica della luce del sole. Come dire:
Energia radiante Glucosio coenzimi ridotti.....
Questi coenzimi saranno poi riossidati in una catena di trasporto di elettroni, la catena respiratoria, e per ogni NADH ossidato si otterranno 3ATP, mentre per ogni FADH2 se ne formeranno 2 in un processo chiamato fosforilazione ossidativa.
Inoltre il ciclo di Krebs produce un GTP, analogo dell'ATP, a livello di substrato, per ogni acetato.
Vediamo tra i nove, i passaggi cruciali del ciclo di Krebs, seguendo lo schema.
Nel primo passaggio si ha l'addizione dell'acetato all'ossalacetato, un chetoacido fondamentale non solo nel metabolismo energetico. Un composto a quattro atomi di carbonio condensa con l'unità acetile formando un composto a sei atomi di carbonio.
Si forma il primo acido tricarbossilico: il citrato. Il CoA si libera pronto per un nuovo acetato... se ce n'è bisogno.
i passaggi due e tre sono isomerizzazioni che portano all'isocitrato. Si ha dapprima una deidratazione con formazione di un doppio legame e la successiva addizione di acqua sposta il gruppo OH del citrato in posizione '2. E' la preparazione alla successiva decarbossilazione ossidativa.
Nel passaggio quattro l'isocitrato viene decarbossilato e ossidato da una deidrogenasi NAD dipendente (isocitrato deidrogenasi). Si ha l'ossidazione completa di un atomo di C dell'acetato a CO2 e liberazione di NADH. Si forma un nuovo chetoacido (5 atomi di carbonio) l' a-chetoglutarato che, insieme al piruvato e all'ossalacetato avranno ruoli importanti in altri metabolismi. Segue nella
tappa cinque una nuova decarbossilazione ossidativa con gli stessi prodotti della tappa precedente. A questo punto si completa l'ossidazione di tutti gli atomi di carbonio del glucosio. Questo passaggio è catalizzato dal complesso della a-chetoglutarato deidrogenasi con meccanismo molto simile a quello della PDH: infatti si addiziona anche CoA e si forma il succinil-CoA, con 4 atomi di C.
Nel successivo passaggio, (6) l'idrolisi del legame tioestere, che ha un ∆G°' = -35 KJ, libera l'energia necessaria per favorire la sintesi del legame fosfoanidridico del GTP, analogo dell'ATP. Si ha così produzione di energia a livello del substrato. Il succinato che ne deriva sarà ossidato due volte, nel passaggi 7, in cui operano le flavoproteine formando FADH2 e 9 produzione di nuovo NADH) per rigenerare l'ossalacetato che è l'importante chetoacido che finisce il ciclo e lo ricomincia accettando l'acetato.
Alcuni bilanci
Considerando un giro completo del ciclo dell'acido citrico è facile capire che nella prima metà i due atomi di carbonio dell'acetato che entra e che si somma all'ossalacetato, vengono completamente ossidati entrambi a CO2. Nell'altra metà il ciclo si "occupa" di rigenerare l'ossalacetato necessario per la ripresa del ciclo. Nelle quattro ossidazioni i coenzimi NAD+ e FAD raccolgono molti elettroni che trasferiranno nella catena respiratoria portando alla sintesi di molte molecole di ATP. Alla fine del ciclo tutti e sei gli atomi di carbonio del glucosio hanno perso gli elettroni e quindi l'energia di legame, trasferita momentaneamente ai coenzimi nucleotidici. Le sei molecole di diossido di carbonio si sono formate nei seguenti passaggi:
|
Piruvato ----→ |
acetato |
2 CO2 (una per ogni piruvato) |
|
isocitrato |
a-chetoglutarato |
2 CO2 (una per ogni isocitrato) |
|
a-chetoglutarato |
succinil-CoA |
2 CO2 (una per ogni a-chetoglutarato) |
Sappiamo che alla bomba calorimetrica la combustione completa del glucosio libera circa 680 Kcal/mole. Per fare un bilancio della "resa" energetica del processo d'ossidazione cellulare, se il glucosio viene ossidato completamente attraverso il ciclo di Krebs e gli elettroni trasferiti all' ossigeno dalla catena respiratoria, occorre calcolare quante moli di ATP vengono prodotte nel processo.
La seguente tabella schematizza il numero di moli di ATP prodotte nelle varie fasi:
|
moli di ATP |
tappe di produzione |
|
2 2x3= 6 6 3x2x3= 18 2x2= 4 TOTALE = 38moli |
a livello di substrato nella glicolisi dalla riossidazione del NADH citoplasmatico dalla riossidazione dei 2 NADH prodotti nella deidrogenazione del piruvato a livello di substrato nel ciclo di Krebs dalla riossidazione dei 3x2 NADH prodotti nel ciclo di Krebs dalla riossidazione dei 2 FADH2 prodotti nel ciclo di Krebs |
Quindi nella ossidazione completa del glucosio si ottengono 38 moli di ATP e cioè una quantità di energia libera, espressa in calorie, di:
38 x 7.3 Kcal/mole = 277, 4 Kcal
che rappresenta circa il 40% della quantità totale dell'energia (liberata in ambiente fisico: bomba calorimetrica) contenuta nei legami del glucosio.
Alcune importanti considerazioni
Il ciclo dell'acido citrico oltre ad essere centrale nel metabolismo energetico è anche una fonte di precursori fondamentali per alcune biosintesi.
Questo significa che alcuni intermedi possono essere sottratti al
ciclo per essere utilizzati come precursori per alimentare vie metaboliche
biosintetiche fondamentali. Si dice perciò che il ciclo dell'acido citrico è
una via anfibolica, che vuol dire che è collocata sia nelle via
cataboliche che in quelle anaboliche e quindi la sua funzione è essenziale
anche 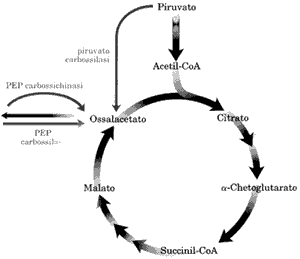 senza considerare il ruolo nel metabolismo energetico.
Il citrato può uscire dai mitocondri e fungere da precursore per la
sintesi di acidi grassi. Anche l'ossalacetato e l'α-chetoglutarato
possono essere sottratti dal ciclo per la sintesi di aminoacidi. L'ossalacetato,
può anche convertire in fosfoenolpiruvato, PEP, tramite la PEPcarbossichinasi.
Il PEP, già visto nella glicolisi, può servire per la sintesi di glucosio (gluconeogenesi).
senza considerare il ruolo nel metabolismo energetico.
Il citrato può uscire dai mitocondri e fungere da precursore per la
sintesi di acidi grassi. Anche l'ossalacetato e l'α-chetoglutarato
possono essere sottratti dal ciclo per la sintesi di aminoacidi. L'ossalacetato,
può anche convertire in fosfoenolpiruvato, PEP, tramite la PEPcarbossichinasi.
Il PEP, già visto nella glicolisi, può servire per la sintesi di glucosio (gluconeogenesi).
Come sappiamo i livelli d'ossalacetato però devono rimanere costanti per permettere il normale flusso del ciclo, essendo l'accettore degli acetati. Per ricostituire la normale concentrazione di ossalacetato esistono altre vie, dette anapletoriche, utili per rimpiazzare l'ossalacetato sottratto. Una delle più importanti è la carbossilazione del piruvato con CO2 per formare ossalacetato catalizzata dall'enzima piruvato carbossilasi. In condizioni normali deve esistere un equilibrio perfetto tra le reazioni che rimuovono intermedi e quelle, anapletoriche, che lo riforniscono di tali intermedi.
La catena respiratoria
La catena respiratoria è costituita da una serie di trasportatori, molti dei quali sono proteine integrali di membrana (interna), i cui gruppi prostetici sono in grado di accettare e cedere uno o due elettroni. L'accettore finale è l'ossigeno.
Il complesso I è una NADH deidrogenasi su cui vengono incanalati tutti i NADH prodotti nelle ossidazioni compreso quello glicolitico dello shuttle malato-aspartato. Gli ioni idruro vengono trasferiti all'ubichinone (UQ)detto anche coenzima Q secondo la reazione:
NADH + H+ + UQ NAD+ + UQH2 (ubichinolo)
Il flusso di elettroni attraverso il complesso I è accompagnato da spostamento di protoni dalla matrice allo spazio intermembrana.
Il complesso II è la succinato deidrogenasi, enzima del ciclo di Krebs ed è la sede sella riossidazione del FADH2. Anch'esso, come il complesso I trasferisce gli elettroni all'ubichinone, riducendolo ad ubichinolo. Anche la glicerolo 3-P deidrogenasi, enzima di membrana rivolto verso lo spazio intermembrana (non presente in figura) che riossida il NADH citosolico trasportato dalla shuttle del glicerolo 3-P, trasferisce gli elettroni all'ubichinone.
L'ubichinone,
in figura CoQ, è una molecola idrofobica,
completamente immerso nella membrana mitocondriale nella quale diffonde liberam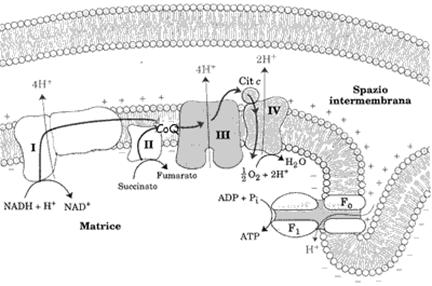 ente
spostandosi nel doppio strato lipidico. La sua forma ossidata contiene due
gruppi carbonilici che possono accettare due elettroni e due protoni
riducendosi completamente a ubichinolo avente due gruppi alcolici.
ente
spostandosi nel doppio strato lipidico. La sua forma ossidata contiene due
gruppi carbonilici che possono accettare due elettroni e due protoni
riducendosi completamente a ubichinolo avente due gruppi alcolici.
UQ + 2e + 2H+ UQH2
L'UQH2 diffonde dal complesso I al complesso III, dove viene riossidato.
Il complesso III è il complesso che riossida l'ubichinolo ed è costituito da citocromi b e c. Il citocromo c è una proteina solubile che, come tutti i citocromi, ha come gruppo prostetico l'eme, contenente Fe che accetta elettroni passando da ferro ferrico a ferro ferroso e viceversa. Esso può spostarsi nella parte polare della membrana per la sua possibilità di fare legami elettrostatici. E' di notevole interesse osservare come il citocromo c sia una proteina presente in tutti gli organismi aerobi con una sequenza aminoacidica che è cambiata di poco nella scala evoluzionistica, segno di una elevata efficienza nel trasportare elettroni che si è selezionata tra tutte quelle possibili.
La riossidazione dell'ubichinolo è accompagnata da un secondo spostamento di protoni dalla matrice allo spazio intermembrana. Si incrementa così il gradiente di concentrazione protonica, iniziato a livello del complesso I, tra le facce della membrana che realizza una differenza di potenziale elettrico e un gradiente di pH.
Il complesso IV, chiamato citocromo ossidasi, contiene ioni rame che partecipano al trasferimento degli elettroni all'ossigeno. Il flusso di elettroni dal citocromo c all'ossigeno determina un nuovo ed ultimo spostamento di protoni dalla matrice verso lo spazio intermembrana.
In conclusione, nei mitocondri, l'azione dei complessi I, III e IV porta elettroni dal NADH all'ossigeno e quello dei complessi II, III e IV, dal succinato (FADH2) all'ossigeno.
La reazione complessiva
NADH + H+ + 1/2 02 H2O + NAD+ ha un ΔG0 ≈ - 52Kcal/mole
Quella che parte dal succinato invece ha un ΔG0 ≈ - 36 Kcal/mole (si salta un sito di spostamento protonico)
Quindi il trasferimento esoergonico di elettroni lungo la catena respiratoria produce energia più che sufficiente per "spingere" la reazione endoergonica che porta alla sintesi di ATP:
ADP + Pi ATP
Come tale energia viene incanalata nella sintesi dell'ATP è un processo che prende il nome di fosforilazione ossidativa
La fosforilazione ossidativa
Abbiamo visto che il flusso di elettroni attraverso la catena respiratoria produce una notevole quantità d'energia. Resta ora da capire come questa energia, liberata dalle ossidazioni biologiche operate dalle deidrogenasi possa rendersi disponibile per la fosforilazione dell'ADP.
Per capire come avvenga l'accoppiamento dell'ossidazione con la fosforilazione dobbiamo conoscere un'altra proteina integrale di membrana: l'ATPsintasi.
L'ATPsintasi è un complesso di membrana formato da due subunità principali, Fo e F1. Come si vede in figura F1 si protende nella matrice ed è il complesso che lega ATP e ADP in diversi siti . Il complesso Fo contiene un canale protonico asimmetrico e proteso verso la matrice mitocondriale.
Esiste una teoria che accoppia l'ossidazione dei substrati alla fosforilazione ed è la teoria chemiosmotica proposta da P. Mitchell nel 1960 e che è alla base dell'attuale ricerca nel campo della trasduzione energetica.
Il flusso elettronico attraverso la membrana interna dei mitocondri è accompagnato da un pompaggio di protoni dalla matrice allo spazio intermembrana. Ciò genera una differenza di potenziale elettrico e una differenza di pH tra i due lati della membrana rendendo quello che guarda la matrice più alcalino.
Questa concentrazione protonica e queste separazione di cariche determinano una energia elettrochimica che prende il nome di forza motrice protonica che rappresenta la forma di conservazione dell' energia prodotta e liberata nelle ossidazioni biologiche.
Il pompaggio contro gradiente protonico avviene con consumo d'energia e quindi avrà un ΔG > 0.
La membrana mitocondriale è impermeabile ai protoni che non possono così rientrare per annullare il gradiente elettrochimico.
Ma quando questi potranno fluire attraverso i canali protonici specifici posti nel complesso Fo dell'ATPsintasi in direzione del gradiente elettrochimico, si renderà disponibile una quantità di energia pari al ΔG consumato per il trasporto in senso contrario (reso possibile dal flusso elettronico).
Il complesso F1 condenserà un fosfato all'ADP per generare ATP.
In definitiva quindi la generazione di ATP dai nutrienti, ed in particolare dal glucosio seguirà le seguenti tappe:
Energia radiante Glucosio coenzimi ridotti energia elettrochimica di membrana ATP
Per ogni NADH riossidato si ha un flusso protonico in tre siti e si otterranno 3 moli di ATP.
Per ogni FADH2 riossidato si avranno solo 2 ATP perché viene bypassato il complesso I. Lo stesso vale per il NADH citosolico trasportato dal glicerolo 3-P.
 L'ATP
prodotto nella matrice mitocondriale deve essere esportato fuori dai mitocondri
ma sappiamo che la membrana interna è impermeabile a quasi tutte le sostanze a
meno che non abbiamo sistemi di trasporto proteici specifici.
L'ATP
prodotto nella matrice mitocondriale deve essere esportato fuori dai mitocondri
ma sappiamo che la membrana interna è impermeabile a quasi tutte le sostanze a
meno che non abbiamo sistemi di trasporto proteici specifici.
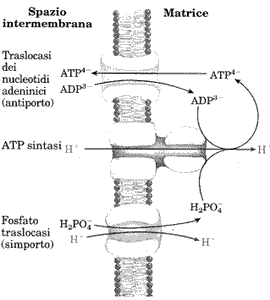
Vi sono importanti sistemi di trasporto nella membrana mitocondriale interna che operano il trasporto di ADP e Pi nella matrice e consentono l'uscita dell'ATP neo formato.
L'enzima fondamentale è l'ATP-ADP traslocasi che funziona come un antiporto.
Il fosfato entra nella matrice con un simporto favorito dal rientro degli ioni idrogeno a favore di gradiente.
Quindi la forza motrice protonica fornisce l'energia necessaria alla sintesi di ATP e nel contempo favorisce il trasporto dei substrato (ADP e Pi) nella matrice e i prodotti della reazione (ATP).
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025