|
|
| |
CORSO DI BIOTECNOLOGIE ANNO 2006/2007
RELAZIONE DI FISICA
TITOLO: il calore specifico dell'ottone;
SCOPO DELL'ESPERIENZA: misura del calore specifico dell'ottone mediante l'utilizzo del calorimetro delle mescolanze;
MATERIALI UTILIZZATI
![]() calorimetro delle mescolanze con
capacità 750 ml;
calorimetro delle mescolanze con
capacità 750 ml;
![]() termostato contenente acqua calda
a (73.30 0.05)
°C;
termostato contenente acqua calda
a (73.30 0.05)
°C;
![]() miscelatore;
miscelatore;
![]() campione d'ottone con massa (201.0
0.5) g;
campione d'ottone con massa (201.0
0.5) g;
![]() un bottiglione "mariotte" con
acqua a temperatura ambiente;
un bottiglione "mariotte" con
acqua a temperatura ambiente;
![]() carta millimetrata per la
costruzione dei grafici;
carta millimetrata per la
costruzione dei grafici;
STRUMENTI DI MISURA
|
NOME STRUMENTO |
PORTATA |
RISOLUZIONE |
ERRORE SULLA MISURA |
|
beker graduato |
500 ml |
10 ml |
5 ml |
|
cilindro graduato |
250 ml |
10 ml |
5 ml |
|
cronometro digitale |
|
1 s |
0.5 s |
|
termometro digitale (per il calorimetro) |
- |
0.1 °C |
0.05 °C |
|
termometro digitale (per la misura della temperatura ambiente) |
- |
0.1 °C |
0.05 °C |
|
bilancia digitale |
2000 g |
1 g |
0.5 g |
PROCEDIMENTO PER
taratura della bilancia con il cilindro graduato;
prelevamento di una massa m2 di acqua a temperatura ambiente e sua pesatura;
taratura della bilancia con il beker;
prelevamento di una massa d'acqua calda m1 dal termostato e sua pesatura;
inserimento della massa m1 nel calorimetro, chiusura del calorimetro e inizio della stima dell'andamento della temperatura con un intervallo di tempo di 3sec., durante l'agitamento dell'acqua con il miscelatore;
dopo aver prelevato 10 valori circa, apertura del calorimetro e aggiunta della massa m2 d'acqua e chiusura calorimetro, prendendo nota della temperatura ambiente;
prosecuzione della stima delle temperature, appena il termometro comincia a segnare variazioni stabili della temperatura, con un intervallo di 3 sec., continuando ad agitare con il miscelatore;
PROCEDIMENTO PER
I METODO:
pesatura della massa mc dell'ottone avendo cura di prendere il campione tramite il filo di nylon;
taratura della bilancia con il beker;
prelevamento di una massa d'acqua calda m1 dal termostato e sua pesatura;
inserimento della massa m1 nel calorimetro, chiusura del calorimetro e inizio della stima dell'andamento della temperatura con un intervallo di tempo di 3sec., durante l'agitamento dell'acqua con il miscelatore;
dopo aver prelevato alcuni valori, apertura del calorimetro e aggiunta del campione d'ottone prendendo nota della temperatura ambiente;
prosecuzione della stima delle temperature, appena il termometro comincia a segnare variazioni stabili della temperatura, con un intervallo di 3 sec., continuando ad agitare con il miscelatore;
II METODO
durante la seconda stima delle temperature, taratura della bilancia con il cilindro graduato;
prelevamento e pesatura di una massa d'acqua m2 a temperatura ambiente;
apertura del calorimetro e aggiunta della massa m2 prendendo nota della temperatura ambiente;
prosecuzione della stima delle temperature con lo stesso intervallo di tempo continuando ad agitare con il miscelatore;
La stima delle temperature, dopo la chiusura del calorimetro, può essere interrotta dopo aver prelevato un numero di valori tale che ci sia un abbassamento della temperatura di mezzo grado centigrado.
INTRODUZIONE - CALCOLO DELLA MASSA EQUIVALENTE DEL CALORIMETRO
L'esperienza è stata effettuata per ricavare sperimentalmente e in maniera indiretta il calore specifico dell'ottone.
Il calore specifico di un corpo esprime la quantità di calore da fornire alla massa di un grammo del corpo per provocarne l'innalzamento della temperatura di un grado centigrado. Quanto più questa quantità è alta tanto più il riscaldamento del corpo sarà minore per una stessa fornitura di calore, rispetto ad un corpo con un calore specifico minore.
Per poter calcolare il calore specifico dell'ottone ci siamo avvalsi della relazione:
Q = m * Cs * T
che lega in una relazione di proporzionalità diretta il calore scambiato da un corpo con la sua massa, il suo calore specifico e il salto termico subito; ma questa relazione è sfruttabile solo se si conosce il calore che il corpo scambia per subire il salto termico. Per risolvere questo problema abbiamo inserito il campione d'ottone assieme ad una massa d'acqua a temperatura più alta di quella dell'ottone, in un calorimetro delle mescolanze: un dispositivo che isola al meglio il sistema, costituito dall'acqua e dal campione d'ottone, dall'ambiente esterno. In questo modo il calore ceduto dall'acqua, perché a temperatura maggiore, non sarà disperso ma completamente assorbito dal campione e dal calorimetro stesso tramite i suoi componenti.
Prima di eseguire quindi ogni tipo di calcolo e di misura dobbiamo conoscere quanto calore di quello ceduto dall'acqua sarà assorbito dal calorimetro e dai suoi componenti, cioè in sostanza conoscere la capacità termica di ogni singolo oggetto in maniera tale da tenerne conto nei calcoli effettuati.
La capacità termica è data dal prodotto della massa dell'oggetto per il suo calore specifico, è quindi una quantità calcolabile, ma diventa scomoda da aggiungere nei calcoli eseguiti; si può però cercare di approssimare le capacità termiche di ogni singolo oggetto alla capacità termica che avrebbe un'ipotetica massa d'acqua m* che non sarà inserita nel calorimetro, ma sostituirà nei calcoli le capacità termiche degli oggetti del calorimetro: questa massa è definita massa equivalente ed è caratteristica per ogni calorimetro.
La prima parte dell'esperienza è stata quindi volta alla determinazione di m* per il calcolo della quale abbiamo applicato la relazione che lega il calore scambiato dai corpi in un sistema isolato.
Aggiungendo una massa d'acqua calda m1 a temperatura T1 nel calorimetro e successivamente una massa d'acqua m2 a temperatura ambiente T2, esse insieme al calorimetro scambieranno calore fino al raggiungimento di una temperatura d'equilibrio, allora visto che il sistema è, almeno idealmente, isolato e non c'è dispersione di calore, la somma dei calori acquistati dalla massa d'acqua a temperatura ambiente Q2 e dal calorimetro q, cioè da m*, più il calore ceduto dalla massa d'acqua calda Q1 sarà nulla:
Q1 + Q2 + q = 0
da questa relazione possiamo ricavarci la formula per il calcolo della massa equivalente:
m2 (Te - T2)
![]() m* = - m1
m* = - m1
(T1 - Te)
FORMULE UTILIZZATE PER IL CALCOLO DEL CALORE SPECIFICO DELL'OTTONE
Adesso quindi avendo la possibilità di calcolare il calore scambiato dal calorimetro con i corpi contenuti al suo interno possiamo procedere con il calcolo del calore specifico dell'ottone, ciò lo abbiamo fatto tramite due esperimenti successivi e completamente indipendenti l'uno dall'altro.
Nel primo esperimento sono state poste nel calorimetro una massa d'acqua calda e il campione d'ottone che si trovava a temperatura ambiente, essi hanno scambiato calore fino al raggiungimento di una temperatura di equilibrio intermedia fra la temperatura dell'acqua calda e di quella dell'ottone; a questo punto impostando l'equivalenza fra il calore ceduto dalla massa d'acqua calda e quello assorbito dall'ottone e da m* possiamo ricavarci la formula per il calcolo del calore specifico dell'ottone Cc che aveva una massa mc e una temperatura Tc:
(m1 + m*)(T1 -Te)
![]() Cc1 = Cl
Cc1 = Cl
mc (Te - Tc)
dove m1 la massa d'acqua calda a temperatura T1, e Cl è il calore specifico dell'acqua.
Nel secondo esperimento abbiamo operato aprendo il calorimetro e inserendo una massa d'acqua m2 a temperatura ambiente T2 al sistema "acqua + ottone + m*" che essendo all'equilibrio aveva una temperatura più alta di quella ambiente. C'è stato un nuovo scambio di calore che ha portato ad una nuova temperatura di equilibrio alla quale il calore ceduto dal sistema è uguale a quello acquistato da m2; da qui possiamo ricavare una seconda formula per il calcolo del calore specifico:
![]()
![]()
m2 (Te - T2) m1 + m*
![]()
![]() Cc2 = Cl
-
Cc2 = Cl
-
mc (T1 - Te) mc
STUDIO DELL'ANDAMENTO DELLA TEMPERATURA NEL CALORIMETRO
Anche se il calorimetro può essere approssimato ad un sistema idealmente isolato, per una misura più precisa del valore del calore specifico dell'ottone dobbiamo considerare che in realtà il calorimetro disperde calore nel tempo. La sua temp 222e47c eratura interna quindi diminuisce nel tempo e inoltre non è possibile misurare le temperature durante le fasi di apertura, durante le quali viene oltre tutto disperso altro calore.
La temperatura iniziale per ogni esperimento non corrisponderà mai alla temperatura dell'acqua calda aggiunta, in quanto questa diminuirà nel tempo, quindi la temperatura iniziale sarà effettivamente quella all'apertura del calorimetro; la temperatura di equilibrio invece sarà quella all'istante dell'immissione dell'oggetto, che può essere l'acqua a temperatura ambiente o l'ottone, ma in quell'istante non è misurabile.
Sperimentalmente è stata ricavata la legge che indica l'andamento della temperatura nel calorimetro nel tempo: è una relazione esponenziale decrescente che lega la qualità del calorimetro, espressa dalla costante di tempo t, direttamente proporzionale alla qualità del calorimetro; la sua temperatura interna all'istante iniziale T0; la temperatura esterna cioè quella ambiente Ta:
T(t) = Ta + (T0 +Ta) * e(-t/ t)
espressa in logaritmi questa relazione diventa lineare decrescente:
ln (T(t) - Ta) = ln (T0- Ta) - t/ t
questo andamento è costante se il calorimetro resta chiuso, quando lo si apre quindi non si potrà definire il suo andamento, ma se ipotizziamo che l'istante di apertura sia infinitesimo, e che quindi il calore disperso a causa dell'apertura sia trascurabile, possiamo ipotizzare costante l'andamento della temperatura nel tempo anche nei punti dove la temperatura è indeterminabile e in tal modo costruire un grafico nel quale, interpolando i punti, ricaviamo le temperature all'istante di apertura e di inserimento dell'oggetto, cioè le temperature iniziali e di equilibrio.
Per costruire il grafico abbiamo preso il valore delle temperature ogni tre secondi; riportando i valori del logaritmo naturale della temperatura in funzione del tempo abbiamo dovuto inoltre riportare i valori degli errori su ogni temperatura, espressi dal rapporto fra l'errore del termometro e il valore della temperatura.
Agendo in questo modo l'interpolazione è stata più semplice e precisa in quanto i valori sono stati interpolati non con una sola retta, ma con due rette, una con massima pendenza e una con pendenza minima, in tal modo ci siamo ricavati due valori per il logaritmo del valore di temperatura cercato, tra cui è stata fatta la media aritmetica per ricavare il valore del logaritmo della temperatura in esame.
|
|
|
|
|
|
|
|
|||||
|
|
TEMPERATURE MASSA EQUIVALENTE |
|
|||||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
TEMPO (s) ± 0,5 s |
|
TEMPERATURA (°C) ± |
|
ln T |
|
ERRORI SU ln T: ± |
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
IMMISSIONE DELLA MASSA m1 D'ACQUA CALDA |
|
|
|||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
IMMISSIONE DELLA MASSA m2 D'ACQUA A TEMPERATURA AMBIENTE |
|
||||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
Per l'inserimento della massa d'acqua a temperatura ambiente il calorimetro è stato aperto a 30 secondi e chiuso a 40 secondi, quindi la temperatura iniziale e di equilibrio sono state ricavate dall'incrocio delle rette di interpolazione con l'ascissa dei 35 secondi.
|
|
|
|
|
|
|
|
|||||
|
|
TEMPERATURE PER IL Cs DELL'OTTONE |
|
|||||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
TEMPO (s) ± 0,5 s |
|
TEMPERATURA (°C) ± |
|
ln T |
|
ERRORI SU ln T: ± |
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
IMMISSIONE DELLA MASSA m1 D'ACQUA CALDA |
|
|
|||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
IMMISSIONE DELLA MASSA mc DELL'OTTONE |
|
|
|||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
TEMPO (s) ± 0,5 s |
|
TEMPERATURA (°C) ± |
|
ln T |
|
ERRORI SU ln T: ± |
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
IMMISSIONE DELLA MASSA m2 D'ACQUA A TEMPERATURA AMBIENTE |
|
||||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
TEMPO (s) ± 0,5 s |
|
TEMPERATURA (°C) ± |
|
ln T |
|
ERRORI SU ln T: ± |
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
Per l'inserimento della massa del campione d'ottone il calorimetro è stato aperto a 36 secondi e chiuso a 46 secondi, quindi la temperatura iniziale e di equilibrio sono state ricavate dall'incrocio delle rette di interpolazione con l'ascissa dei 41 secondi.
Invece per l'inserimento della massa d'acqua a temperatura ambiente il calorimetro è stato aperto a 165 secondi e chiuso a 175 secondi, quindi la temperatura iniziale e di equilibrio sono state ricavate dall'incrocio delle rette di interpolazione con l'ascissa dei 170 secondi.
DATI PROVENIENTI DALLO STUDIO DEI GRAFICI E DALL'INTERPOLAZIONE DEI VALORI
|
|
ln T retta a pendenza massima |
ln T retta a pendenza minima |
valore medio ln T |
Temperatura |
semidispersione massima |
errore sulla temperatura |
|
massa equivalente |
|
|
|
|
|
|
|
temperatura iniziale |
|
|
|
|
|
± |
|
temperatura d'equilibrio |
|
|
|
|
|
± |
|
I metodo per il calcolo del calore specifico |
|
|
|
|
|
|
|
temperatura iniziale |
|
|
|
|
|
± |
|
temperatura d'equilibrio |
|
|
|
|
|
± |
|
II metodo per il calcolo del calore specifico |
|
|
|
|
|
|
|
temperatura iniziale |
|
|
|
|
|
± |
|
temperatura d'equilibrio |
|
|
|
|
|
± |
ln TMAX + ln TMIN
![]() valore medio ln T =
valore medio ln T =
2
Valore di T = eln T
ln TMAX - ln TMIN
![]() semidispersione massima =
semidispersione massima =
2
errore sulla temperatura = (semidispersione massima) * T
MASSA EQUIVALENTE E SUO ERRORE
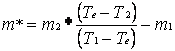 =
= 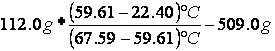 13.25 g
13.25 g
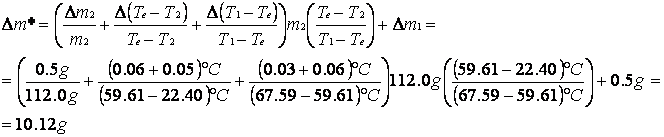
CALORE SPECIFICO DELL'OTTONE E SUO ERRORE CON IL PRIMO METODO
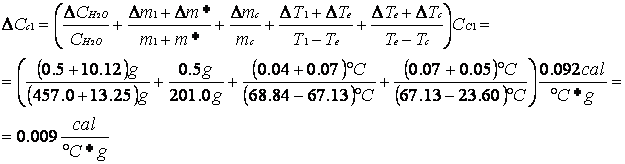
CALORE SPECIFICO DELL'OTTONE E SUO ERRORE CON IL SECONDO METODO
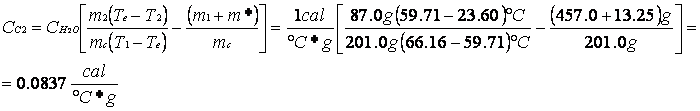
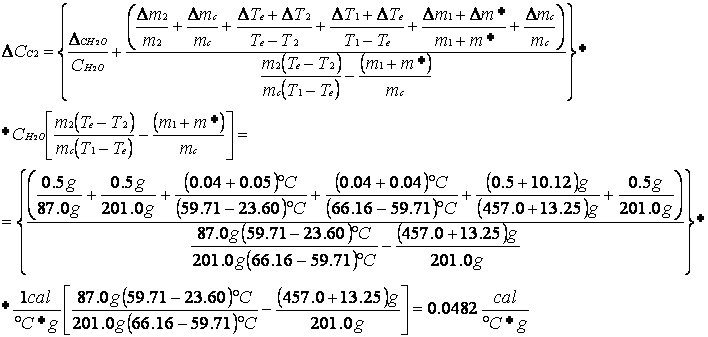
|
Calore specifico dell'acqua |
Ca |
1 cal /(°C*g) |
|
|
|
|
|
CALCOLO DELLA MASSA EQUIVALENTE |
|
|
|
|
|
|
|
Massa d'acqua calda |
m1 |
(509,0 ± 0,5) g |
|
Massa d'acqua a temperatura ambiente |
m2 |
(112,0 ± 0,5) g |
|
Temperatura ambiente della massa d'acqua m2 |
T2 |
(22,40 ± 0,05) °C |
|
Temperatura iniziale dell'acqua calda |
T1 |
(67.59 ± 0.03) °C |
|
Temperatura d'equilibrio |
Te |
(59.61 ± 0.06) °C |
|
Massa equivalente |
m* |
(13,25 ± 10.12) g |
|
|
|
|
|
CALCOLO DEL CALORE SPECIFICO DELL'OTTONE |
|
|
|
|
|
|
|
I METODO |
|
|
|
Massa d'acqua calda |
m1 |
(457,0 ± 0,5) g |
|
Massa del campione d'ottone |
mc |
(201,0 ± 0,5) g |
|
Temperatura ambiente dell'ottone |
Tc |
(23,60 ± 0,05) °C |
|
Temperatura iniziale dell'acqua calda |
T1 |
(68,84 ± 0.04) °C |
|
Temperatura d'equilibrio sistema acqua + ottone |
Te |
(67,13 ± 0.07) °C |
|
Calore specifico dell'ottone |
Cc1 |
(0,092 ± 0.009) cal/(°C*g) |
|
|
|
|
|
II METODO |
|
|
|
Temperatura iniziale sistema acqua + ottone |
T1 |
(66,16 ± 0.04) °C |
|
Massa d'acqua a temperatura ambiente |
m2 |
(87,0 ± 0,5) g |
|
Temperatura ambiente della massa d'acqua m2 |
T2 |
(23,60 ± 0,05) °C |
|
Temperatura d'equilibrio |
Te |
(59,71 ± 0.04) °C |
|
Calore specifico dell'ottone |
Cc2 |
cal/(°C*g) |
TABELLA DEI DATI
COMMENTO DEI DATI E CONSIDERAZIONI PERSONALI
Applicando le formule ricavate in precedenza abbiamo potuto calcolare due valori per il calore specifico dell'ottone con i relativi errori.
Attraverso l'analisi di questi errori abbiamo deciso di considerare il primo valore come il più attendibile e preciso perché presenta un'incertezza inferiore al secondo valore, segno che l'esecuzione del primo metodo è stata più accurata e precisa.
La scelta del primo valore è stata supportata anche dall'analisi dei grafici, questi inoltre hanno permesso di verificare l'andamento esponenziale decrescente assunto dalla temperatura interna al calorimetro nel tempo, espressa nel grafico da un andamento lineare decrescente del logaritmo naturale della temperatura.
A causa di questo andamento, nella seconda parte dell'esperienza non è stato possibile osservare e rilevare variazioni frequenti della temperatura, infatti, avendo questa un andamento esponenziale decrescente e asintotico con la temperatura esterna al calorimetro, le variazioni della temperatura avranno un'entità minore man mano che si avvicinano al valore della temperatura ambiente e non potranno essere apprezzate dal termometro decimale utilizzato nell'esperienza. Ciò non permette di prendere dei valori accurati per la costruzione di un buon grafico e non permette quindi di effettuare delle interpolazioni precise e di prendere valori accurati delle temperature per il calcolo del calore specifico nel secondo metodo.
Per cercare di rendere più accurate le interpolazioni, il grafico è stato costruito senza l'inserimento dei valori delle temperature immediatamente successivi alla chiusura del calorimetro, in quanto questi variavano in maniera troppo rapida e avevano un andamento instabile per poter essere rilevati con un intervallo di tre secondi. Inoltre nell'interpolazione sono stati tralasciati quei valori la cui variazione è stata eccessiva perché erano trascurabili in quanto tutti gli altri valori avevano l'andamento lineare ipotizzato.
Gli errori riscontrati sulle misure sono stati determinati soprattutto dalla bilancia digitale che era molto imprecisa, aveva infatti una sensibilità di un grammo; questa imprecisione si è rivelata di un certo peso soprattutto nel calcolo della massa equivalente, il cui errore si avvicina molto al suo valore effettivo.
Per poter aumentare l'accuratezza delle misure avremmo dovuto innanzitutto usare strumenti più precisi e anche un calorimetro con una costante di tempo più elevata. Ma è stato utile prendere determinati accorgimenti che ci hanno comunque condotto ad un valore accettabile per il calore specifico dell'ottone:
il primo e il più importante accorgimento riguarda il coperchio del calorimetro, esso va tenuto naturalmente, aperto il minor tempo possibile per minimizzare gli scambi di calore con l'esterno per evitare che la temperatura discosti di molto dal suo andamento;
l'acqua calda da inserire nel calorimetro deve avere una temperatura molto elevata in maniera tale da avere nel tempo una lettura precisa e utile delle variazioni della temperatura, evitando che questa si avvicini troppo al valore della temperatura ambiente. Inoltre la quantità d'acqua deve bastare a sommergere il bulbo del termometro almeno per metà della sua lunghezza, altrimenti c'è il rischio di rilevare i valori non della temperatura dell'acqua, ma dell'aria contenuta nel calorimetro. Ciò potrebbe essere evitato riempiendo completamente il calorimetro, ma successivamente si verserebbe fuori il contenuto all'aggiunta di altre masse d'acqua o all'aggiunta del campione d'ottone;
il miscelatore inserito nel calorimetro è da utilizzare sia durante la misura della temperatura dell'acqua calda, sia all'aggiunta delle altre masse. All'inizio è utile per evitare la formazione di gradienti termici, questi si vengono a creare perché l'acqua tende a formare dei moti turbolenti che spostano le masse d'acqua calda e fredda, le une verso l'alto e le altre verso il basso. Dopo le aggiunte nel calorimetro è invece utile per velocizzare e uniformare gli scambi di calore. Ma il miscelatore va usato moderatamente in quanto si rischia di fornire del calore al sistema che può far variare e falsare le variazioni di temperatura;
infine il campione d'ottone non va toccato con le mani per evitare di modificare la sua temperatura prima dell'inserimento nel calorimetro; per questo è stato munito di un filo di nylon attraverso il quale deve essere maneggiato. Il filo permette inoltre di inserire con delicatezza il campione d'ottone nel calorimetro per evitare che le pareti di quest'ultimo si rompano.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2026