|
|
| |
Titolo: MISURAZIONE DEL pH DI ALCUNE SOLUZIONI
Premessa: Precedentemente, avendo osservato in alcuni esperimenti che l'acqua non conduce corrente elettrica, abbiamo dedotto che essendo una sostanza molecolare, allo stato puro non presenta ioni. Ma se avessimo usato un voltometro molto sensibile avremmo notato che l'acqua manifesta una debolissima conducibilità, per cui sono presenti alcuni ioni: delle molecole d'acqua dissociata.
![]()
![]()
per cui:
![]()
in cui la concentrazione di ioni ![]() e
e ![]() sono in misura uguale.
Invece per quanto riguarda la concentrazione dell'acqua si può considerare
costante per cui:
sono in misura uguale.
Invece per quanto riguarda la concentrazione dell'acqua si può considerare
costante per cui:
![]()
in cui ![]() rappresenta il
prodotto ionico dell'acqua. Quindi:
rappresenta il
prodotto ionico dell'acqua. Quindi:
![]()
Aggiungendo NaCl, in 343d35d altre parole ioni stabili, questi non modificano la concentrazione di ioni idrogeno o ossidrili, che rimangono sempre costanti. Per cui la soluzione si può sempre definire neutra (ovvero le concentrazioni dei due ioni sono uguali), anche se non pura.
Se invece aggiungessimo HCl (sostanza molecolare che si ionizza in acqua):
![]()
Gli ioni di
idrogeno si aggiungono a quelli presenti nell'acqua, per cui la soluzione
diventa acida, infatti dovendo essere il prodotto ionico dell'acqua costante,
avverrà che: 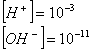
Aggiungendo invece NaOH, sostanza solubile e ionica:
![]()
per cui la concentrazione degli ioni varierà:
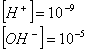 in cui prevale la
concentrazione di
in cui prevale la
concentrazione di ![]() , per cui la soluzione è basica.
, per cui la soluzione è basica.
Differente è il comportamento dell'ammoniaca:
![]()
![]()
cattura ioni idrogeno dall'acqua.
pH = ![]()
![]()
Meno usato è il pOH = ![]()
ESPERIMENTO
Materiali: cartina indicatrice (contente un
mix di indicatori, cambia colore al variare del pH), acqua distillata, idrossido
di sodio ![]() M, acido cloridico
M, acido cloridico ![]() M, cloruro di sodio, bicarbonato di sodio.
M, cloruro di sodio, bicarbonato di sodio.
Procedimento: abbiamo versato alcune gocce di ognuna di queste sostanze in soluzione acquosa su dei piccoli pezzi di cartina indicatrice.
Dati sperimentali: abbiamo osservato che le cartine assumevano differenti colorazioni.
Procedimento: abbiamo confrontato il colore assunto dai pezzi di cartina indicatrice e li abbiamo confrontati con la scala riportata sull'etichetta.
I valori assunti dalle varie sostanze sono i seguenti:
|
sostanza |
|
NaOH |
HCl |
NaCl |
|
|
colore |
verde |
blu |
rosso |
verde |
verde, blu |
|
pH |
|
|
|
|
|
Dati sperimentali: è da porre in rilievo il comportamento del cloruro di sodio, il cui pH
è 7, come quello dell'acqua distillata. Ciò avviene perché tale sostanza non
altera la concentrazione di ioni ![]() e
e ![]() . È inoltre da sottolineare che la basicità della soluzione
di bicarbonato si verifica grazie ad un particolare procedimento che si attua
in tale situazione: l'IDROLISI. Il bicarbonato di sodio cattura ioni
. È inoltre da sottolineare che la basicità della soluzione
di bicarbonato si verifica grazie ad un particolare procedimento che si attua
in tale situazione: l'IDROLISI. Il bicarbonato di sodio cattura ioni ![]() e rilascia ioni
e rilascia ioni ![]() .
.
Abbiamo poi utilizzato altri tipi di indicatori, delle sostanze che assumono colori differenti a seconda che la soluzione abbia un valore di pH maggiore o minore di una data soglia, la quale appunto varia a seconda dei vari indicatori.
Abbiamo quindi effettuato un altro tipo di esperimento per individuare i colori degli indicatori in soluzioni a acide e basiche.
Materiali: acido cloridico ![]() M, cioè una soluzione fortemente acida, idrossido di sodio
M, cioè una soluzione fortemente acida, idrossido di sodio ![]() M, cioè una soluzione fortemente basica, alcuni indicatori:
fenolftaleina, metilarancio, rosso fenolo, blu di bromotimolo; 8 provette.
M, cioè una soluzione fortemente basica, alcuni indicatori:
fenolftaleina, metilarancio, rosso fenolo, blu di bromotimolo; 8 provette.
Procedimento: abbiamo versato alcune gocce di ogni indicatore sia nell'acido cloridico sia nell'idrossido di sodio.
Dati sperimentali: abbiamo osservato i colori assunti dai vari indicatori, riportati nella tabella sottostante:
|
indicatore |
Fenolftaleina |
metilarancio |
rosso fenolo |
Blu di bromotimolo |
|
Col. in NaOH |
Rosso porpora |
giallo |
viola |
blu |
|
Col. In HCl |
|
rosa |
giallo |
giallo |
|
pH di miraggio |
|
|
|
|
Infine, per spirito di curiosità, utilizzando i metodi fin ora esplicati, abbiamo misurato il pH di due tipi di sapone con due metodi.
In prima analisi abbiamo misurato il valore di pH del sapone di marsiglia e del sapone liquido con la cartina indicatrice: il primo ha mostrato un pH 9/10, il secondo 7.
Abbiamo poi utilizzato la fenolftaleina e il metilarancio prima con il sapone liquido, poi con il sapone liquido, non cambiando colore la prima, diventando giallo il secondo, dimostrando così di avere un pH tra 5 e 9. Poi con il sapone di marsiglia: la soluzione con fenolfatleina ha assunto un colore rosso porpora, il metilarancio arancio, dimostrando così di avere un pH superiore a 9.
Conclusione: con questi esperimenti abbiamo imparato ad utilizzare gli indicatori di pH, e a conoscerne il loro significato.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025