|
|
| |
Formulario di Chimica

Costante di equilibrio (KC)
Data una reazione del genere:
![]()
per la legge di azione di massa (che afferma che a temperatura costante ed a equilibrio raggiunto il prodotto delle concentrazioni delle sostanze prodotte dalla reazione diviso per il prodotto delle concentrazioni delle sostanze reagenti e costante), abbiamo che la costante di equilibrio Ŕ pari a:
![]()
Costante di pressione 858g62i (KP)
La costante di pressione 858g62i Ŕ pari a:
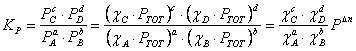
![]()
![]()
Dove KW Ŕ detto prodotto ionico dell'acqua. Una soluzione acida ha un pH compreso tra 0 e 7, una soluzione basica ha un pH compreso tra 7 e 14, mentre una soluzione neutra ha pH pari a 7 (questa
regola non Ŕ fissa infatti soluzioni fortemente acide possono avere pH<0 e soluzioni fortemente basiche pH>14).
Il calcolo del pH cambia a seconda del tipo di soluzione, distinguiamo quindi i diversi casi:
Se siamo in presenza di acido forte il pH sarÓ dato dal cologaritmo della normalitÓ:
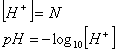
Base Forte
Se siamo in presenza di base forte il pOH sarÓ dato dal cologaritmo della normalitÓ:
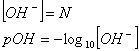
quindi il pH sarÓ dato da:
![]()
Acido Debole
Se siamo in presenza di acidi deboli esso si dissocerÓ secondo la reazione seguente:
![]()
per questo equilibrio vale la seguente relazione:
![]()
dove Ka Ŕ la costante di aciditÓ e [HA] la normalitÓ dell'acido.
Base Debole
Se siamo in presenza di basi deboli esso si dissocerÓ secondo la reazione seguente:
![]()
per questo equilibrio vale la seguente relazione:
![]()
dove Kb Ŕ la costante di basicitÓ e [BOH] la normalitÓ della base.
A volte non viene data la normalitÓ ma la molaritÓ per ricavarmi la normalitÓ devo usare la seguente formula:
![]()
L'idrolisi Ŕ una decomposizione operata dall'acqua sui sali ed anche in questo caso dobbiamo distinguere diversi casi:
Sali formati da acido forte e base forte
In questo caso i sali derivanti dalla neutralizzazione di un acido forte con una base forte, non
provoca variazioni di pH dell'acqua, pertanto in questi casi abbiamo:
![]()
ci˛ significa che la soluzione Ŕ neutra e quindi che la concentrazione del sale non influenza il pH.
Sali formati da base forte e acido debole
In questo caso possiamo ricavare la concentrazione degli OH -, attraverso la seguente relazione:
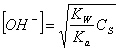
dove KW Ŕ il prodotto ionico dell'acqua, Ka Ŕ la costante di aciditÓ e CS la concentrazione del sale. Da tale relazione possiamo calcolarci:
![]()
il pH in questo caso sarÓ >7.
Sali formati da acido forte e base debole
In questo caso possiamo ricavare la concentrazione degli H+, attraverso la seguente relazione:
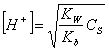
dove KW Ŕ il prodotto ionico dell'acqua, Kb Ŕ la costante di basicitÓ e CS la concentrazione del sale. Da tale relazione possiamo calcolarci:
![]()
il pH in questo caso sarÓ <7.
Sali formati da acido debole e base debole
In questo caso possiamo ricavare la concentrazione degli H+, attraverso la seguente relazione:
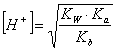
dove KW Ŕ il prodotto ionico dell'acqua, Kb Ŕ la costante di basicitÓ e Ka la costante di aciditÓ. Da tale relazione possiamo calcolarci:
![]()
in questo caso l'ambiente sarÓ poco acido.
Calcolo del pH nel caso di tampone
Le soluzioni tampone sono soluzioni aventi la caratteristica di mantenere costante il loro pH, anche se vengono loro aggiunte quantitÓ variabili di acidi forti o basi forti. Anche in questo caso dobbiamo distinguere diversi casi:
Sali di un acido debole con una base forte in presenza di acido debole in eccesso
In questi casi l'acido debole avrÓ un Ka dato dalla relazione:
![]()
essendo l'acido debole pochissimo dissociato ed il sale quasi completamente dissociato, avremo:
![]()
sostituendo abbiamo:
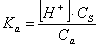
la concentrazione di H+ e quindi il pH sarÓ pari a:
![]()
Sali di una base debole con un acido forte in presenza della base debole in eccesso
In questi casi la base debole avrÓ un Kb dato dalla relazione:
![]()
essendo la base debole pochissimo dissociato ed il sale quasi completamente dissociato, avremo:
![]()
sostituendo abbiamo:
![]()
la concentrazione di OH- , di H+ e quindi il pH sarÓ:
![]()
Grado di dissociazione
Dobbiamo distinguere due casi:
Acido debole
Il grado di dissociazione in questo caso Ŕ pari a:
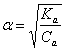
dove Ka Ŕ la costante di dissociazione (o costante di aciditÓ) e Ca la concentrazione iniziale del'acido.
Base debole
Il grado di dissociazione in questo caso Ŕ pari a:
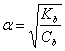
dove Kb Ŕ la costante di dissociazione (o costante di basicitÓ) e Cb la concentrazione iniziale della base.
Per stabilire se siamo in presenza di acidi/basi forti/deboli
Esiste una regola empirica per determinare la forza di un ossiacido: se nella formula, la differenza tra il numero di atomi di ossigeno e il numero di atomi di idrogeno vale almeno 2: l'acido Ŕ forte; nel caso valga meno di 2: l'acido Ŕ debole
Base Forte idrossidi dei metalli del primo e secondo gruppo del sistema periodico
Base debole idrossidi dei metalli dei restanti gruppi del sistema periodico

|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024