|
|
| |
FATTORI CHE INFLUENZANO LA VELOCITA DELLE REAZIONI
SCOPO DELL'ESPERIENZA
La velocità di reazione dipende da alcuni fattori fra cui la temperatura a cui avviene la reazione e la presenza di catalizzatori.
Scopo di quest'esperimento è veri 242c29c ficare come tali fattori influenzano una reazione.
MATERIALE OCCORRENTE
Buretta da 50 ml;
Termometri;
Cronometro;
Apparato riscaldante;
9 becher da 100 ml;
Bacchette di vetro;
Soluzioni di KMnO4 0,1 M; 0,2 M; 0,5 M;
Soluzione di H2SO4 1 M;
Soluzioni di acido ossalico 0,1 M; 0,2 M; 0,5 M;
MnSO4 solido.
ANALISI INIZIALE DELLE DUE ESPERIENZE
L'esperimento condotto è articolato in due serie di prove, ognuna delle quali mostra l'influenza di un solo fattore sulla velocità di reazione tra l'acido ossalico e il per, manganato di potassio in presenza di acido solforico.
Si tratta di una reazione di ossido riduzione che si rappresenta con la seguente equazione (per questo, a volte, le reazioni di ossido riduzione sono chiamate equazioni chimiche).
![]() 2 KMnO4
+ 5 C2H2O4 + 3 H2SO4 2 MnSO4
+ K2SO4 + 10 CO2 + 8 H2O
2 KMnO4
+ 5 C2H2O4 + 3 H2SO4 2 MnSO4
+ K2SO4 + 10 CO2 + 8 H2O
Analizzando i dati della prima esperienza si ricaverà che la velocità di reazione è influenzata dalla temperatura e, in particolare, aumenta con l'aumentare della temperatura.
Dai dati della seconda esperienza si potrà visualizzare che la presenza di un catalizzatore può far variare la velocità pur rimanendo inalterati gli altri parametri: temperatura e concentrazione.
In particolare si potrà osservare che piccole quantità di MnO2 fanno aumentare notevolmente la velocità di reazione.
EFFETTO DELLA TEMPERATURA
Preparare quattro becher da 100 ml contenenti ciascuno 26 ml di H2C2O4 0,1 M e 10ml di H2SO4 1M.
Portare ciascun becher ad una temperatura definita via crescente: ad esempio, il primo becher a temperatura ambiente, il secondo a quaranta gradi centigradi, il terzo a settanta gradi centigradi e il quarto all'ebollizione.
Aggiungere rapidamente in ciascuna soluzione, agitando con una bacchetta di vetro, 10 ml di KMnO4 0,1 M.
Cronometrare il tempo necessario alla decolorazione.
TABELLE E GRAFICI
Costruire una tabella relativa alla temperatura assoluta (in K) /tempo (in s).
Costruire un grafico riportando sull'asse delle ascisse i valori del tempo e sull'asse delle ordinate la temperatura assoluta.
|
|
TEMPERATURA |
TEMPO IMPIEGATO |
|
1^ PROVA |
Ambiente |
09.20.00 minuti |
|
2^ PROVA |
40°C |
00.55.00 minuti |
|
3^ PROVA |
70°C |
00.10.00 minuti |
|
4^ PROVA |
100°C |
00.07.00 minuti |
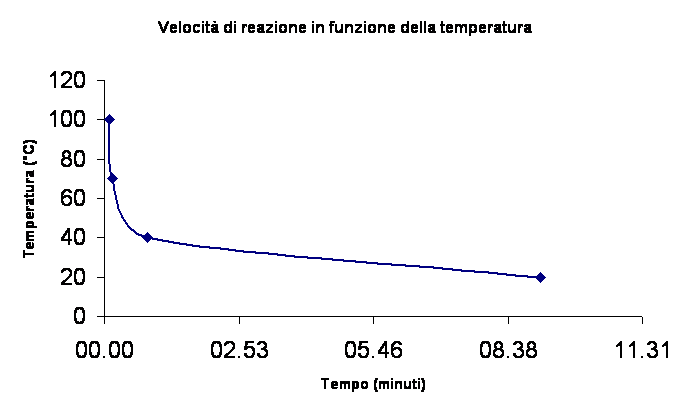
ANALISI DELL'ESPERIENZA
Il grafico riportato descrive l'andamento della velocità di reazione.
È una proporzionalità inversa: all'aumentare di una variabile l'altra diminuisce.
In questo caso all'aumentare della temperatura il tempo di reazione diminuisce.
Proprio per questo l'andamento del grafico è rappresentato da un'iperbole.
La conclusione è evidente: più la temperatura della soluzione è alta e più veloce sarà la reazione di ossido riduzione.
EFFETTO DEL CATALIZZATORE
Preparare due becher contenenti ciascuno 26 ml di H2C2O4 0,1M + 10 ml di H2SO4 1M.
Aggiungere al primo becher 10 ml di KMnO4 0,1M a temperatura ambiente.
Agitare e cronometrare il tempo necessario per la decolorazione che indica che la reazione è avvenuta.
Eseguire le stesse operazioni con il secondo becker aggiungendo anche una punta di spatola di MnSO4.
Cronometrare il tempo di reazione e confrontare il valore ottenuto con quello relativo alla prima prova.
TABELLE E CALCOLI
|
Primo becher |
Senza catalizzatore |
11.30.00 minuti |
|
Secondo becher |
Con catalizzatore |
00.07.55 minuti |
ANALISI DELL'ESPERIENZA
È evidente che la reazione ha impiegato molto meno tempo ad avvenire con il catalizzatore, che senza catalizzatore.
Nel primo becher, infatti, la sostanza si è decolorata dopo più di 11 minuti mentre nel secondo becher la decolorazione è avvenuta dopo soli sette secondi.

|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024