|
|
| |
Verifica della legge di Charles
Scopo
Verifica della legge di Charles ( o prima legge di Gay-Lussac )
Principio
La legge di Charles afferma che a pressione costante la variazione di volume di un gas è direttamente proporzionale alla variazione della temperatura.
Se la temperatura è espressa in °C la relazione è:
![]()
Dove:
V(T): volume del gas ad una data temperatura T
Vo = volume del gas a 0°C
T = temperatura ( °C )
(°C-1) = 1/273,15 (rappresenta la differenza di volume relativo a Vo riferito all'aumento di 1°C di temperatura)
Da questa legge deriva che a T = -273,15°C αT = -1 e VT = 0
Per temperature più basse VT diventa negativo e ciò è impossibile perciò T = -273,15°C è definito come ZERO ASSOLUTO e corrisponde alla temperatura di 0°K (gradi Kelvin)
Se la temperatura invece è espressa in K la formula diventa:
![]()
Dove:
T = temperatura (K)
Ma Vo = volume del gas a 0°C o 273,15 °K
T = temperatura ( °K )
(°K-1) = 1/273,15 (rappresenta la differenza di volume relativo a Vo riferito all'aumento di 1°K di temperatura).
Da notare che α è sempre uguale, infatti l'ampiezza di 1°C corrisponde a quella di 1°K, pertanto l'aumento di volume relativo a Vo (adimensionale) riferito all'unità di temperatura (°C-1 o °K-1) non cambia passando da °C a °K.
Per verificare la legge di Charles utilizzeremo un capillare chiuso da un lato e aperto dall'altro, all'interno del quale è stata intrappolata una bolla d'aria grazie ad una goccia di mercurio.
La pressione esercitata sulla bolla d'aria è costante ed è uguale alla pressione atmosferica più quella esercitata dalla goccia di mercurio.
A questo punto non resta che variare la temperatura e misurare con una scala millimetrata l'altezza della goccia di mercurio.
La prima legge di Gay-Lussac è sperimentalmente verificata per pressioni non troppo elevate e per temperature non troppo prossime alla temperatura di liquefazione del gas, ovvero quando il gas si comporta come un gas ideale.
Materiali
Schema
Termometro e capillare Cilindro graduato Piastra


Procedimento
Si prende il capillare che ha un lato chiuso e vi si inserisce una goccia di mercurio, che funge da stantuffo, la quale intrappola una determinata quantità di aria. Si verifica l'altezza dell'apice inferiore dello stantuffo di mercurio utilizzando il righello, posto a fianco del capillare.
Si attende che la temperatura sia uniforme all'interno e all'esterno del capillare e che quindi la goccia di mercurio stabilizzi.
Si è posto poi il capillare, insieme al termometro, all'interno di un cilindro graduato contenente dell'acqua a temperatura ambiente. Si è poi aggiunto all'interno del cilindro dei cubetti di ghiaccio per portare il liquido a 5°C (t), mescolando lentamente il tutto con il termometro per omogeneizzarne la temperatura. Per effetto della diminuzione di temperatura il volume del gas diminuisce, la goccia scende fino al raggiungimento della nuova posizione di equilibrio. Si riporta questa altezza in corrispondenza della temperatura misurata in °C. In seguito si pone un becker pieno d'acqua sulla piastra fino a raggiungere i 60°C, si travasa l'acqua nel cilindro graduato,e si immerge nell'acqua il capillare con il termometro. Dopo di che si annota l'altezza dell'apice inferiore dello stantuffo e lo si riporta in tabella in corrispondenza della temperatura misurata in °C.
Bisogna far attenzione che durante queste operazioni la goccia di mercurio non si separi in piccole parti, evitando quindi movimenti bruschi.
Dati ed elaborazione dati
Ricordiamo che la propagazione degli errori segue le seguenti leggi:
L'errore associato alla somma o differenza di grandezze è uguale alla somma degli errori assoluti di ogni singola grandezza.
L'errore associato al prodotto o alla divisione di grandezze è uguale alla somma degli errori relativi di ogni singola grandezza.
Prendiamo in considerazione le tabelle dei dati allegate:
Se mettiamo in parallelo la legge di Charles e l'equazione di una retta abbiamo:
V = VoαT + Vo (legge di Charles)
y = mx + c (equazione di una retta)
Se y = V e x = T, come nel nostro caso in cui abbiamo riportato in grafico il volume contro la temperatura, allora il coefficiente angolare della retta m dovrebbe essere uguale a Voα e l'intercetta a Vo
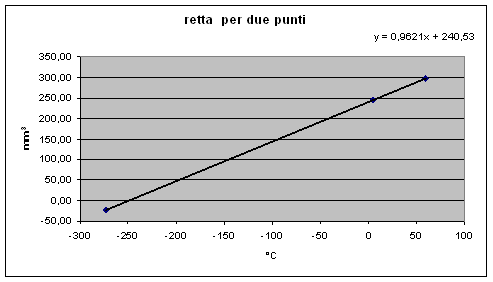
La retta ottenuta da noi è:
y = 0,9621x + 240,53
dove y = mm3 e x = T°C
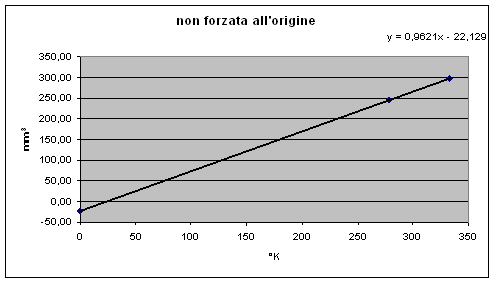
riportando i valori in gradi Kelvin la retta ottenuta è:
y = 0,9621x - 22,129
le due rette, come si vede, sono parallele in quanto hanno lo stesso coefficiente angolare
valutiamo ora gli errori associati alla curva:
Abbiamo due punti: (y1;x1) e (y2;x2)
y1= 298,25 mm3 ± 19,45 mm3 x1= 60°C ± 1°C
y2= 245,34 mm3 ± 16,42 mm3 x2= 5°C ± 1°C
m = (y1- y2) / (x1- x2) l'errore relativo sarà :
ER =[(19,45+16,42)/(298,25-245,34)] + [(1+1)/(60-5)]= (35,87/52,91)+(2/55)=0,678+0,036=0,714
EA = 0,714 x 0,9621 = 0,687 perciò:
m = 0,9621 ± 0,687
per calcolare c, alla funzione y = mx + c sostituiamo uno dei due punti y;x:
c = y - mx e l'errore assoluto sarà (per il punto a 5°C) = 16,42 + [(0,714+0,2)x4,81] = =16,42+4,40= 20,82 perciò:
c = 240,53 ± 20,82
V calcolato a -273,15 estrapolato dalla retta = -22,27 mm3 ± [20,82+(0,714x262,79)] = -22,27 mm3 ± 208 mm3!!!!
applicando la legge di Charles:
Vo (60°C)= 244,54 ± 16,68 (vedi tabella)
Vo (5°C) = 240,93 ± 17,00 (vedi tabella)
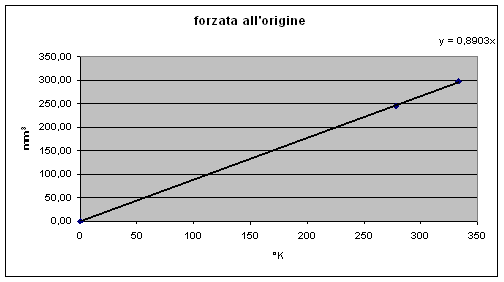
Voα (60°C) = x 1 / 273,15 = 0,8953 ± 0,061
Vo (5°C) = 240,93 x 1 / 273,15 = 0,8820 ± 0,062
V calcolato a -273,15 secondo Charles = 0 mm3 ± 34 mm3
Osservazioni
I dati in nostro possesso confermano la bontà della legge di Charles in quanto i valori ottenuti applicando la legge ai nostri dati sperimentali per calcolare i valori a T = 0°C e T = 0°K e valutandone l'errore associato, concordano con quelli estrapolati dalla retta ottenuta riportando in grafico i volumi contro le temperature.
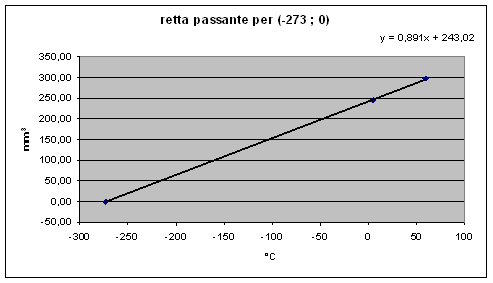
In effetti applicando la legge di Charles si andavano a considerare le rette passanti per il punto (-273,15 ; 0 ) e i punti misurati da noi.
Possiamo affermare quindi che i nostri punti sperimentali e quelli relativi a 0°C e 0°K calcolati secondo Charles stanno sulla stessa retta a meno degli errori di misura che come si può valutare non sono di piccola entità, specialmente quelli relativi alla curva di taratura.
In effetti piccole (relativamente!) variazioni di inclinazione della retta tra 5°C e 60°C comportano grandi variazioni di misura a -273°C.
L'errore è più contenuto applicando la legge di Charles in quanto i punti tra qui passa la retta sono lo zero assoluto e ciascun punto misurato riducendo quindi la possibilità di oscillare della retta in quanto i due punti sono molto distanti tra di loro.
Occorrerebbero quindi, per ridurre l'errore, misure su più punti e ripetute più volte nonché sistemi di misura più sensibili.
Tabelle e grafici
Con gradi K

Con °C

|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025