|
|
| |
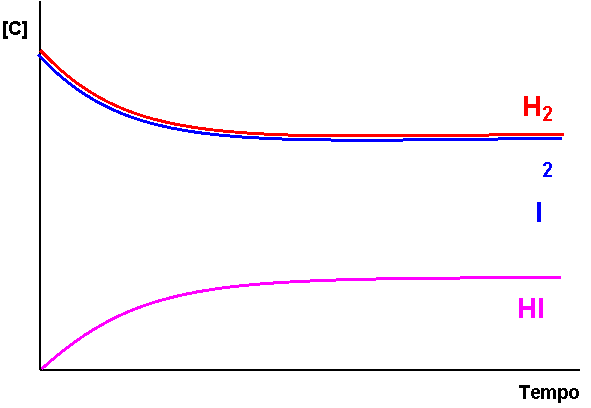 H2 + I2
H2 + I2 ![]() 2HI
2HI
La composizione della miscela di reazione rimane dopo un certo tempo, costante.
Si instaura fra reagenti e prodotti un equilibrio dinamico in cui HI si forma con la stessa velocità con cui si decompone.
aA + bB ![]() cC + dD
cC + dD
si instaura sempre uno stato di equilibrio tra reagenti e prodotti
STATO D'EQUILIBRIO DI UNA REAZIONE
Le quantità di reagenti e di prodotti rimangono inalterate nel tempo all'equilibrio
La trasformazione avviene nei due sensi coinvolgendo le stesse quantità di sostanze (equilibrio dinamico).
Lo stato di equilibrio di una reazione è indipendente dal cammino percorso per raggiungerlo.
Una reazione procede spontaneamente nel senso in cui l'energia libera (G) del sistema diminuisce.
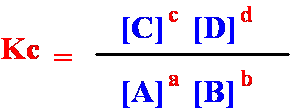
Le concentrazioni delle sostanze all'equilibrio non sono indipendenti le une dalle altre ma debbono soddisfare una condizione (matematica) espressa dalla LEGGE DI AZIONE DI MASSA.
Il rapporto tra il prodotto delle concentrazioni molari dei prodotti di reazione ed il prodotto delle concentrazioni molari dei reagenti all'equilibrio, ciascuna concentrazione elevata ad una potenza pari al coefficiente stechiometrico con cui la specie compare nella reazione, è costante a temperatura costante.
aA + bB ![]() cC + dD
cC + dD

SIGNIFICATO E UTILITA' DELLA COSTANTE D'EQUILIBRIO
Il valore numerico della costante d'equilibrio indica quale sia la concentrazione dei prodotti di reazione rispetto a quella dei reagenti nella miscela all'equilibrio, cioè alla fine della reazione.


![]()

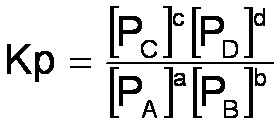
Per reazioni allo stato gassoso:

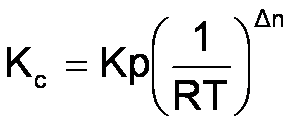
da cui

Cosa succede se il sistema all'equilibrio viene perturbato
Parametri di equilibrio:
Sistema: Temperatura, Pressione, Volume
Sostanze: Concentrazioni (pressioni)
N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
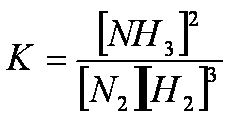
Principio di Le Chatelier: se si modificano i parametri che determinano lo stato di equilibrio di un sistema, questi reagisce in maniera da opporsi alla variazione apportata
Le sostanze solide presenti nella reazione non compaiono nella legge di azione di massa
Per le sostanze gassose si impiega la loro pressione parziale
Per le sostanze liquide la loro concentrazione
Esempi:
CaCO3 (s) ![]() CaO(s) + CO2
CaO(s) + CO2
Fe(s) + 2Cr3+(aq)
![]() Fe2+(aq) + 2Cr2+(aq)
Fe2+(aq) + 2Cr2+(aq)
Sn(s) + 2H+(aq)
![]() Sn2+(aq) + H2(g)
Sn2+(aq) + H2(g)
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025