|
|
| |
Relazione N. 8: Osservazioni Sulle Propriet Delle Sostanze Polari E Delle Sostanze Apolari.
Esperimento N°1
Riempiamo una buretta di acqua.
Strofiniamo una bacchetta che si carica positivamente
Apriamo il rubinetto che si trova nella parte terminale del tubicino verticale della buretta ed avviciniamo la bacchetta.
Notiamo che l'acqua viene attratta dalla bacchetta.
Strofiniamo un'altra bacchetta che si carica negativamente.
Avviciniamo la bacchetta all'acqua che scende
Notiamo che anche in questo caso essa viene attratta.
Riempiamo una buretta di isottano.
Apriamo il rubinetto della buretta e vi avviciniamo la bacchetta carica positivamente.
Notiamo che anche l'isottano viene attratto dalla bacchetta ma pochissimo.
Avviciniamo ora all'isottano la bacchetta carica negativamente e notiamo che anche ora esso viene attratto ma poco.
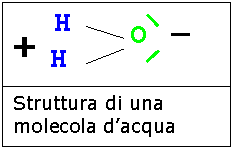
Visto che l'acqua viene attratta dall'oggetto carico possiamo dedurre che è una sostanza polare mentre viceversa l'isottano che non viene attratto è una sostanza apolare.
Miscugli Di Sostanze Polari e Sostanze Apolari
Per questa serie di sperimentazioni abbiamo utilizzato le seguenti sostanze:
![]() Cloroformio CHCl3
Cloroformio CHCl3
![]() Isottano C8H18
Isottano C8H18
![]() Alcool Etilico assoluto (quasi puro)
Alcool Etilico assoluto (quasi puro)
![]() Iodio I: solido, grigio, lucente, in polvere
Iodio I: solido, grigio, lucente, in polvere
Mettiamo dell'acqua in una provetta.

Aggiungiamo del cloroformio.
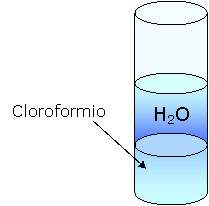
L'isottano è più denso dell' acqua in quanto va a fondo mentre non è polare perché non si scioglie in essa.
Aggiungiamo dell'isottano.
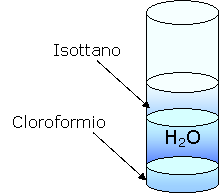
L'isottano è meno denso dell' acqua in quanto galleggia. inoltre non è polare perché non si scioglie.
Agitiamo la provetta:
possiamo avere 3 diversi tipi di risultati
a) Il cloroformio è in quantità maggiore rispetto all'isottano e quindi attribuisce una maggiore densità alla soluzione che quindi affonda.
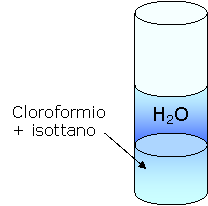
b) L'isottano è presente in quantità maggiore rispetto al cloroformio e quindi attribuisce alla soluzione una minor densità per cui essa galleggia.
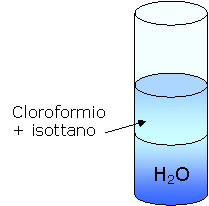
c) L'isottano e il cloroformio sono presenti in quantità uguali e quindi rimangono in sospensione nell'acqua.
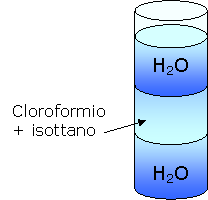
Le due sostanze si sono potute sciogliere grazie al fatto che agitando la provetta esse sono potute venire a contatto. In conclusione il cloroformio e l'isottano sono sostanze apolari
in quanto non si sciolgono in acqua e visto che si sciolgono l'uno nell'altro ("I simili sciolgono i simili").
Mettiamo in una provetta dell'acqua.

Aggiungiamo dell'alcool etilico.
 Nonostante che come può
sembrare a una prima indagine l'alcool etilico non è una sostanza polare come
si potrebbe giustificare dal fatto che si scioglie in acqua. Essa infatti è una
sostanza apolare ma capa-
Nonostante che come può
sembrare a una prima indagine l'alcool etilico non è una sostanza polare come
si potrebbe giustificare dal fatto che si scioglie in acqua. Essa infatti è una
sostanza apolare ma capa-
 ce di formare legami a
idroge-no e di conseguenza di sciogliersi in acqua.
ce di formare legami a
idroge-no e di conseguenza di sciogliersi in acqua.
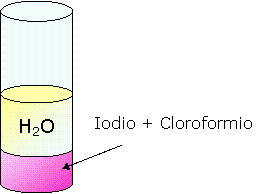
 Mettiamo dello iodio in una provetta
Mettiamo dello iodio in una provetta
Aggiungiamo dell'acqua.
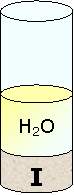
Solamente una piccola parte di iodio si scioglie nell'acqua per cui possiamo affermare che lo iodio non è solubile in acqua e di conseguenza si tratta di una sostanza apolare.
Aggiungiamo del cloroformio.
Lo iodio si scioglie nel cloroformio come possiamo notare dal fatto che lo iodio cambia colore e stato di aggregazione: da solido a liquido. Lo iodio si scioglie bene nel cloroformio perché entrambi sono sostanze apolari a differenza dell'acqua che è una sostanza polare.
La Conducibilità.
Avvalendoci dell'aiuto di un tester controlliamo la conducibilità di acqua quasi pura: notiamo che il tester quasi non reagisce quando viene a contatto con questa sostanza. Possiamo quindi dire che l'acqua non conduce l'elettricità.
Controlliamo ora la conducibilità o meno di comune acqua potabile. Notiamo che l'acqua potabile conduce l'elettricità grazie alla presenza di sostanze sciolte in essa.
Prendiamo una provetta e mettiamoci una sostanza ionica: il cloruro di sodio cioè il comune sale da cucina.

![]()
Aggiungiamo dell'acqua.

Otteniamo così un miscuglio di acqua e cloruro di sodio. Utilizzando il tester notiamo che questa soluzione conduce la corrente elettrica. Il cloruro di sodio è una sostanza ionica.
Controlliamo ora se il composto di acqua pura e zucchero conduce: il tester non reagisce. Per cui possiamo dedurre che lo zucchero non è una sostanza ionica ne polare quindi deve essere in grado di formare legami a idrogeno per potersi sciogliere in acqua.
Miscugli Di Sostanze Polari e Sostanze Apolare
L'alcool etilico è uno dei migliori solventi esistenti. Perché può sciogliere le sostanze apolari visto che anch'esso lo è ed in oltre può sciogliersi in acqua grazie alla sua capacità di formare legami a idrogeno.
L'alcool etilico è formato da due parti: una più polare e l'atra meno polare.
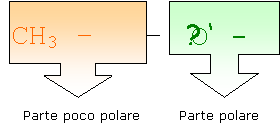
Mettiamo in una provetta dell'alcool etilico.

Aggiungiamo del sale

Il sale non si è sciolto nell'alcool perché è una sostanza polare a differenza dell'alcool e non può formare legami ad idrogeno.
Mettiamo in una provetta dell'alcool etilico.

Aggiungiamo dello zucchero.

Lo zucchero non si scioglie nell'alcool, nonostante che sia una sostanza apolare, perché i legami tra le molecole di zucchero sono molto forti e riescono a contrastare i deboli legami che invece si formerebbero tra le molecole di questu'ultimo e tra quelle di alcool.
Proviamo ad aggiungere dell'acqua.

L'alcool, lo zucchero e l'acqua si sono sciolti completamente perchè sia l'alcool che lo zucchero si sciolgono nell'acqua.
Mettiamo in una provetta del solfato di rame.

Il solfato di rame è una sostanza ionica di formula: CuSO4 + 5H2O.
È un sale e come la maggior parte di essi è colorato a maggior ragione per il fatto di contenere un metallo: il rame che appartiene alla parte centrale della tavola degli elementi
Aggiungiamo dell'acqua.

Notiamo che la sostanza si è completamente sciolta
nell'
acqua acquistando un colore azzurro intenso.
Mettiamo in un'altra provetta dell'altro solfato di rame

Mettiamo la provetta sul una fiamma e aspettiamo:

La parte che si trova più vicino alla fiamma è divenuta più chiara quasi bianca e si è formato del vapore.
Mettiamo dell'acqua nella provetta e notiamo che il
solfato di rame riacquista il suo colore originale possiamo quindi dedurre che
il solfato di rame si trova comunemente sciolto all'
acqua. L'acqua infatti rimane intrappolata nel reticolo ionico e sono proprio
quest'ultime a dare la colorazione blu.

Mettiamo in una provetta dello iodio

Mettiamo la provetta a contatto con la fiamma e aspettiamo qualche secondo:

Lo iodio passa dallo stato solido a quello gassoso e sublima. Lo iodio è quindi un solido che ha una bassa temperatura di fusione e queste caratteristiche lo fanno corrispondere al tipo di sostanza molecolare.
Mettiamo in una provetta dell'acetone

Aggiungiamo dell'acqua

L'acetone si scioglie in acqua per cui deve essere o una so-
stanza polare o in grado di formare legami a idrogeno.
Mettiamo dell'altro acetone in una provetta.

Aggiungiamo dell'olio e notiamo che esso si scioglie perfettamente nell'acetone.

Ne risulta che l'acetone è una sostanza apolare capace però di sciogliersi in acqua.
Prendiamo dell'altro acetone e uniamoci questa volta dell'isottano.

L'acetone è un ottimo solvente in quanto scioglie sia l'isottano che è una sostanza apolare, che gli acidi grassi che l'acqua.
Aggiungiamo questa volta all'acetone lo iodio e notiamo che anche questo viene sciolto.

Mettiamo dell'acqua in una provetta.

Aggiungiamoci un acido grasso, in questo caso l'acido palminico.

L'acqua non scioglie l'acido palminico perché, come tutti gli acidi grassi, è una sostanza idrofoba.
Prendiamo del cobalto.


Aggiungiamoci dell'acqua

Notiamo che come era
successo per il solfato di rame anche in questo caso è l'acqua che conferisce
il colore al cobalto. questa sostanza ha infatti la capacità di trattenere le
particelle d'acqua che si trovano nell'
ambiente divenendo così un materiale utile per divenire un indicatore di umidità.
Mettiamo in una provetta dell'acido palmitico

Aggiungiamo dell'etere. Per etere si intendono tutte quelle sostanze facilmente vaporizzabili. Noi in questa sequenza di esperimenti utilizzeremo l'etere di etilico.
Aggiungiamo dell'acqua

L'acqua non scioglie l'etere e l'acido palmitico.
Estraiamo avvalendoci di una pipetta un po' di acido palmitico sciolto in etere e depositiamolo in un vetro da orologio.
Aspettiamo qualche minuto
Nel vetrino da orologio è rimasta una solo una polverina che non è altro che l'acido palminico che è rimasto dopo che l'etere si è vaporizzato.
Mettiamo in una provetta dell'acido palmitico e aggiungiamoci dell'alcool.

Anche in questo caso l'acido si scioglie ma mento velocemente che nell'etere.
Proviamo ora a miscelare dell'etere a dell'alcool:

Mettiamo dell'acido palmitico in una provetta ed avviciniamola alla fiamma del fornellino.

Notiamo che l'acido palimitico ha una bassa temperatura di fusione: si tratta quindi di una sostanza molecolare. Inoltre una volta lasciato a raffreddare indurisce divenendo un solido dalla consistenza cerosa.
Prendiamo ora della canfora

Mettiamola a contatto con una fiamma

La canfora diviene gialla e sui lati della provetta si forma un alone bianco che è la canfora che dopo essersi vaporizzata venendo a contatto con le pareti fredde della provetta solidifica. Per cui la canfora, essendo una sostanza che fonde a bassa temperatura è una sostanza molecolare.
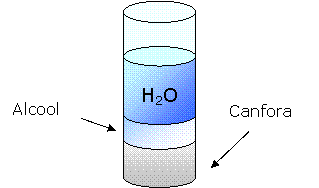
Mettiamo dell'alcool in una provetta ed aggiungiamoci della canfora.

Ne ricaviamo l'alcool canforato.
![]() Aggiungiamo dell'acqua.
Notiamo che l'alcool e la canfora si separano sedimentando
Aggiungiamo dell'acqua.
Notiamo che l'alcool e la canfora si separano sedimentando
Prendiamo del cloruro cobaltoso

Aggiungiamoci dell'acqua

Notiamo che mano a mano che l'acqua si scioglie la nostra soluzione diviene sempre di un colore più acceso.
Prendiamo del cromato di potassio e mettiamolo in una provetta

![]()
Aggiungiamo dell'acqua e come prima notiamo che il colore della soluzione diviene sempre più intenso.
Mettiamo del solfato ferroso (carica ionica +2) in una provetta

Come prima aggiungiamo dell'acqua e anche questa volta notiamo che il colore della soluzione diviene più intenso.
Tabella Riassuntiva
|
Sostanza |
Conduttore |
Polare |
Apolare |
Ionico |
Legami a idrogeno |
Molecolare |
|
H2O |
No |
Sì |
No |
No |
Sì |
|
|
Alcool etilico |
|
No |
Sì |
No |
Sì |
|
|
Cloroformio |
|
No |
Sì |
No |
No |
|
|
Isottano |
|
No |
Sì |
No |
No |
|
|
Iodio |
|
No |
Sì |
No |
No |
Sì |
|
Cloruro di sodio |
Sì |
No |
No |
Sì |
No |
|
|
Zucchero |
No |
No |
Sì |
No |
Sì |
|
|
Solfato di rame |
|
No |
No |
Sì |
No |
|
|
Acetone |
|
No |
Sì |
No |
No |
|
|
Etere di etilico |
|
No |
Sì |
No |
No |
|
|
Acido palmitico |
|
No |
Sì |
No |
No |
Sì |
|
Canfora |
|
|
|
|
|
Sì |
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024