|
|
| |
RELAZIONE N. 7: Osservazioni sugli effetti dei raggi catodici e dei raggi anodici.
All'interno di un tubo di vetro sigillato in cui può trovarsi, oppure no, a seconda del tipo di constatazioni che vogliamo eseguire, del gas e due sferette di materiale conduttore: l'anodo e il catodo collegate, sempre tramite un materiale conduttore, ad un generatore la cui potenza deve essere, perché l'esperimento abbia successo, di 100.000 volt.

Questa potenza non possiamo raggiungere con le normali batterie visto che hanno una potenza di 4,5 volt, ne tanto meno con la normale rete elettrica (220 volt). Per cui dovremo avvalerci di un trasformatore di corrente.

Per di più la no 434g66e rmale corrente di rete è una corrente alternata cioè il polo negativo si trasforma continuamente in polo positivo e viceversa per quello positivo e dobbiamo collegare quindi al generatore un raddrizzatore

![]()
 Il generatore ha il compito di
inviare la corrente elettrica ai due poli: quella positiva all'anodo e quella
nega-tiva al catodo.
Il generatore ha il compito di
inviare la corrente elettrica ai due poli: quella positiva all'anodo e quella
nega-tiva al catodo.
A seconda della rarefa-zione del gas possiamo fare varie constatazio-ni:
Prima
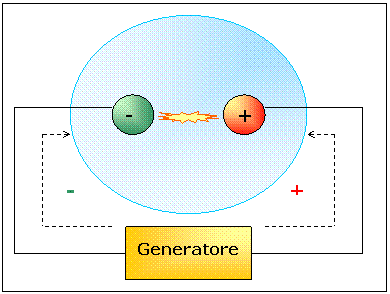 Lasciamo all'interno del
tubo catodico l'aria in percentuale pari a quella dell'esterno. Vediamo che tra
il catodo e l'anodo si forma una piccola scintilla che collega i due poli. Il
concetto è analogo a quello usato per spiegare il fun-zionamento della mac-china
di Wimshurts: i due poli accumulano e-nergia e vengono isolati dall'aria che
come sap-piamo è un materiale isolante, fino a quando, non essendo essa un
isolante perfetto, viene vinta dalla forza di attrazione fra i due poli e si ha
così uno scambio di cariche elettriche.
Lasciamo all'interno del
tubo catodico l'aria in percentuale pari a quella dell'esterno. Vediamo che tra
il catodo e l'anodo si forma una piccola scintilla che collega i due poli. Il
concetto è analogo a quello usato per spiegare il fun-zionamento della mac-china
di Wimshurts: i due poli accumulano e-nergia e vengono isolati dall'aria che
come sap-piamo è un materiale isolante, fino a quando, non essendo essa un
isolante perfetto, viene vinta dalla forza di attrazione fra i due poli e si ha
così uno scambio di cariche elettriche.
Seconda
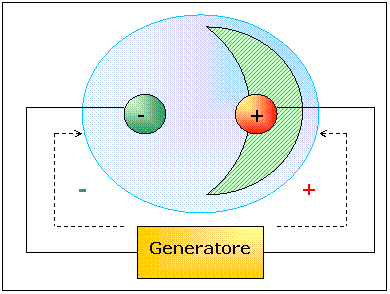 Lasciamo una piccola
quantità di aria. Notiamo che la scintilla scompare ed al suo posto appare una
fosforescenza verde-azzurra in corrispondenza del vetro presente dietro
all'anodo. Notiamo inoltre che se avviciniamo un corpo carico positivamen-te a
questa rilucenza essa ne viene attratta.
Lasciamo una piccola
quantità di aria. Notiamo che la scintilla scompare ed al suo posto appare una
fosforescenza verde-azzurra in corrispondenza del vetro presente dietro
all'anodo. Notiamo inoltre che se avviciniamo un corpo carico positivamen-te a
questa rilucenza essa ne viene attratta.
Terza
Poniamo nel tubo catodico una croce di metallo e notiamo che la fluorescenza che avevamo notato prima si plasma formando un'ombra a forma, appunto, di croce.
In Laboratorio
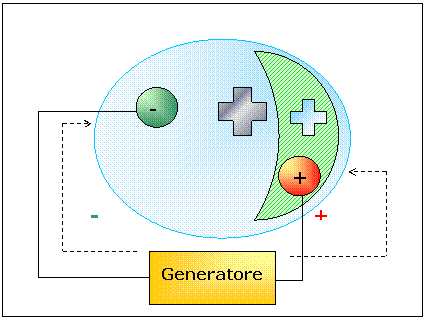 Utilizziamo un tubo
catodico in cui l'anodo ed il catodo sono posizionati non frontalmente ma
l'anodo più in basso in una sorta di rientranza. Questa accortezza è stata concepita
per rendere più evidente questo fenomeno di fosforescenza. Poniamo ora una
crocetta di metallo di fronte al catodo. Accendiamo il generatore e notiamo che
nella fluorescenza c'è come un'ombra a forma di croce.
Utilizziamo un tubo
catodico in cui l'anodo ed il catodo sono posizionati non frontalmente ma
l'anodo più in basso in una sorta di rientranza. Questa accortezza è stata concepita
per rendere più evidente questo fenomeno di fosforescenza. Poniamo ora una
crocetta di metallo di fronte al catodo. Accendiamo il generatore e notiamo che
nella fluorescenza c'è come un'ombra a forma di croce.
Avviciniamo alla fluorescenza un corpo carico positivamente e notiamo che questa luce viene attratta dal corpo ma conservando sempre l'ombra a forma di croce.
Abbassiamo la croce e vediamo che l'ombra nella fluorescenza scompare. Avviciniamo un corpo carico e come prima essa viene attratta.
Quarta
Poniamo al posto della croce una rotellina libera di ruotare. Appena poniamo in funzione il generatore vediamo che essa inizia a ruotare.
Quinta (In Laboratorio)
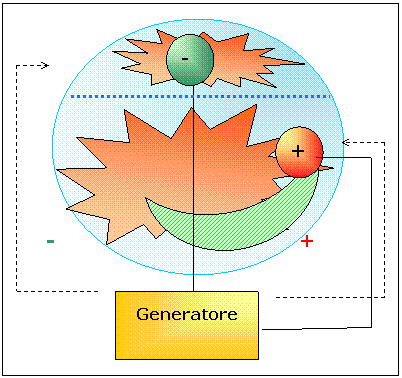 Fino
ad ora abbiamo osservato soltanto un tipo di radiazione (fluorescenza
verde-azzurra) ma ne esiste anche un'altra.
Fino
ad ora abbiamo osservato soltanto un tipo di radiazione (fluorescenza
verde-azzurra) ma ne esiste anche un'altra.
Questa volta utilizziamo un tubo catodico molto particolare dove il catodo è posto in alto rivolto verso l'alto ed l'anodo più in basso, orizzontalmente. Inoltre il catodo è separato dal resto del tubo catodico da una piccola griglia.
All'interno del tubo catodico è presente una piccola quantità di idrogeno. Accendiamo il generatore. Notiamo che oltre alla solita fosforescenza azzurra si forma anche una sorta di luce diffusa di un colore rossastro.
Avviciniamo un corpo carico positivamente e vediamo che la fosforescenza verdastra viene sempre attratta mentre quella rossastra rimane invariata. Se utilizziamo però una calamita caricata positivamente molto potente vediamo che la luce si sposta nella direzione opposta.
Conclusioni
La fluorescenza verde-azzurra non è altro che l'effetto prodotto da una radiazione chiamata radiazione catodica perché proviene dal catodo e va all'anodo. A quest'ultima conclusione ci arriviamo in quanto il corpo caricato positivamente attrae la radiazione che è quindi composta da cariche negative che non possono che provenire dal catodo e sono dirette verso l'anodo che le attrae. La fluorescenza inoltre si ha proprio dietro all'anodo in quanto sono cariche negative che hanno "perso la rotta" e non vanno a finire sull'anodo ma sul vetro del tubo catodico che per effetto di quest'urto produce questa luce verde-azzurra. Da quest'ultima conclusione possiamo facilmente dedurre perché si forma quell'ombra sulla fluorescenza qualora mettiamo davanti al catodo un corpo di metallo, che infatti scherma le radiazioni e le particelle che sarebbero da lì finite sul vetro non possono raggiungerlo.
 Prendiamo
ora in considerazione le radiazioni rossastre. Esse sono l'effetto visibile di
un altro tipo di radiazione: le radiazioni anodiche. Esse sono formate da
cariche positive in quanto vengono respinte dalle cariche positive però non
provengono dall'anodo in quanto sono la parte positiva che rimane di un atomo
una volta che le sue cariche negative si sono separate. In questo caso le
radiazioni anodiche sono formate dalle cariche positive degli atomi di elio.
Inoltre esse devono avere masse molto più grandi rispetto a quelle negative
(per l'idrogeno 2000 volte) in quanto serve una forza molto maggiore per
spostarle. Esse sono poi sempre diverse a seconda del tipo di materiale da cui
hanno origine, mentre le cariche negative sono tutte uguali sia che si cambi il
catodo sia che si usino diversi tipi di gas.
Prendiamo
ora in considerazione le radiazioni rossastre. Esse sono l'effetto visibile di
un altro tipo di radiazione: le radiazioni anodiche. Esse sono formate da
cariche positive in quanto vengono respinte dalle cariche positive però non
provengono dall'anodo in quanto sono la parte positiva che rimane di un atomo
una volta che le sue cariche negative si sono separate. In questo caso le
radiazioni anodiche sono formate dalle cariche positive degli atomi di elio.
Inoltre esse devono avere masse molto più grandi rispetto a quelle negative
(per l'idrogeno 2000 volte) in quanto serve una forza molto maggiore per
spostarle. Esse sono poi sempre diverse a seconda del tipo di materiale da cui
hanno origine, mentre le cariche negative sono tutte uguali sia che si cambi il
catodo sia che si usino diversi tipi di gas.
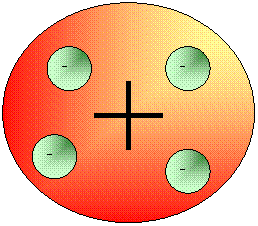
Tutte queste constatazioni portarono alla formulazione del primo modello atomico detto ad anguria od a panettone. In questo modello l'atomo era concepito come una sfera di carica positiva nella quale erano disposti in modo più o meno uniforme le cariche negative, un po' come nell'anguria i semi o nel panettone i canditi. Queste cariche negative erano inoltre libere di muoversi e spostarsi assecondando le forze elettriche alle quali erano esposte.
L'atomo così come lo conosciamo noi venne concepito solo molto più tardi con il modello atomico di Rutherford.
Il Modello atomico di Rutherford
 Rutherford
in seguito ad un esperimento sui comportamenti delle radiazioni emesse da un
campione di radio osservò un comportamento particolare di queste radiazioni da
cui riuscì a dedurre il moderno sistema atomico. Ma vediamo ora il suo esperimento
da più vicino:
Rutherford
in seguito ad un esperimento sui comportamenti delle radiazioni emesse da un
campione di radio osservò un comportamento particolare di queste radiazioni da
cui riuscì a dedurre il moderno sistema atomico. Ma vediamo ora il suo esperimento
da più vicino:
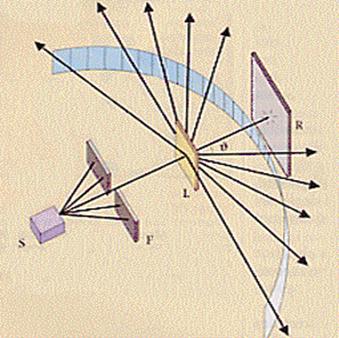
il sistema era formato da:
![]() un campione di radio le cui radiazioni erano schermate da due fogli di
piombo, a parte quelle che riescono a passare dalla fenditura;
un campione di radio le cui radiazioni erano schermate da due fogli di
piombo, a parte quelle che riescono a passare dalla fenditura;
![]() una lamina d'oro molto sottile (10-6 cm) che viene attraversata dalle radiazioni;
una lamina d'oro molto sottile (10-6 cm) che viene attraversata dalle radiazioni;
![]() degli schermi fluorescenti (fatti ad esempio di solfuro di zinco) che
quando sono colpiti da una particolare radiazione divengono fluorescenti ne
luogo in cui vengono colpiti e che permettono di individuare il punto di arrivo
della radiazione stessa. Tali schermi o rivelatori si torvano tutt'intorno al
sistema
degli schermi fluorescenti (fatti ad esempio di solfuro di zinco) che
quando sono colpiti da una particolare radiazione divengono fluorescenti ne
luogo in cui vengono colpiti e che permettono di individuare il punto di arrivo
della radiazione stessa. Tali schermi o rivelatori si torvano tutt'intorno al
sistema
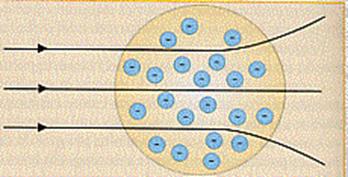 La previsione era che la maggior parte
delle radiazioni emesse dal radio riuscisse ad attraversare l'atomo: quelle che
passavano per il centro non dovevano subire alcuna deviazione, in quanto al
centro doveva trovarsi un certo equilibrio di forze, quelle che passavano un
poco più distanti dal centro dovevano essere deviate di angoli piccolissimi, che
aumentavano all'aumentare della distanza dal centro dell'atomo.
La previsione era che la maggior parte
delle radiazioni emesse dal radio riuscisse ad attraversare l'atomo: quelle che
passavano per il centro non dovevano subire alcuna deviazione, in quanto al
centro doveva trovarsi un certo equilibrio di forze, quelle che passavano un
poco più distanti dal centro dovevano essere deviate di angoli piccolissimi, che
aumentavano all'aumentare della distanza dal centro dell'atomo.
In definitiva si doveva trovare che poche particelle α (cioè le particelle costituenti le radiazioni del radion) risultassero non deviate, mentre la gran parte dovesse risultare deviata.
Si vide che le radiazioni colpivano in modo più forte il punto frontale che appariva quindi molto marcato ma c'erano tutt'intorno una serie di puntolini che determinavano la presenza di radiazioni che erano state deviate durante il percorso di attraversamento della lamina d'oro.
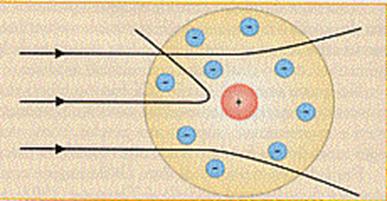 Risultò che le particelle α
venivano deviate sempre di più quanto più passavano vicine al centro dell'atomo
finché, quando passavano nel centro, venivano totalmente riflesse indietro. Da
cui la maggior parte delle radiazioni attraversava la lamina e le restanti o
venivano deviate o addirittura venivano riflesse.
Risultò che le particelle α
venivano deviate sempre di più quanto più passavano vicine al centro dell'atomo
finché, quando passavano nel centro, venivano totalmente riflesse indietro. Da
cui la maggior parte delle radiazioni attraversava la lamina e le restanti o
venivano deviate o addirittura venivano riflesse.
Questo fatto, apparentemente sorprendente, si poteva spiegare solo in un modo: all'interno dell'atomo ci doveva essere una forte concentrazione di carica positiva che determinava la repulsione delle particelle α.
Questa fu la spiegazione che diede Rutherford: l'intera carica positiva, invece di essere distribuita in tutto lo spazio occupato dall'atomo, come si pensava prima della sua teoria, è concentrata in un nocciolo (il nucleo) al centro dell'atomo e tutt'intorno ad esso ruota un sistema di cariche negative.
In questa esperienza le cariche negative (gli elettroni) non disturbavano le radiazioni, infatti il loro comportamento è analogo a quello delle molecole d'aria quando sono attraversate da un proiettile: si spostano. La più grossa conseguenza di questa osservazione fu la scoperta che gli atomi sono in gran parte costituiti da spazio vuoto
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025